Mol e Número de Avogadro
Lista de 10 exercícios de Química com gabarito sobre o tema Mol e Número de Avogadro com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Mol e Número de Avogadro.
01. (Fuvest-SP) A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
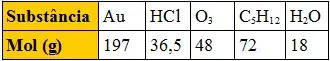
Tabela com mol de substâncias
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
- Au
- HCl
- O3
- C5H10
- H2O
Resposta: E
Resolução:
02. (FCA-PA) O número de mols existentes em 160 g de hidróxido de sódio (NaOH) é: Dados: Na=23; O=16; H=1.
- 2,0 mols
- 3,0 mols
- 4,0 mols
- 5,0 mols
- 6,0 mols
Resposta: C
Resolução:
03. (Ufal) Quantos mols de átomos de hidrogênio há em 0,50 mol de H4P2O7?
- 0,50
- 1,0
- 2,0
- 2,5
- 4,0
Resposta: E
Resolução:
04. (Unicid-SP) Um químico possui uma amostra de cobre (dado: 6429Cu). A massa, em gramas, dessa amostra, sabendo-se que ela é constituída por 3,01 . 1023 átomos, é:
- 0,32 . 1023g
- 0,29 . 1023g
- 1,60 . 1023g
- 64,00 g
- 32,00 g
Resposta: E
Resolução:
05. (UFU-MG) A cafeína, C8H10N4O2, é um estimulante encontrado no chá e no café. Altas doses de cafeína excitam, demasiadamente, o sistema nervoso central, podendo ser letal. Para o homem, a dose letal é, em média, 10 gramas.
Dado: Número de Avogrado = 6,0210²³ partículas/mol.
Nesse caso, o número de átomos de nitrogênio presente na dose letal desse composto é
- 1,24 x 10-²³
- 1,24 x 10²³
- 0,31 x 10²³
- 1,24
Resposta: B
Resolução: Calcular o número de mols de cafeína na dose letal:
Massa molar da cafeína (C₈H₁₀N₄O₂): (812) + (101) + (414) + (216) = 194 g/mol
Número de mols = massa / massa molar = 10 g / 194 g/mol ≈ 0,0515 mol
Calcular o número de moléculas de cafeína:
Utilizando o número de Avogadro: 0,0515 mol * 6,022 x 10²³ moléculas/mol ≈ 3,10 x 10²² moléculas
Calcular o número de átomos de nitrogênio:
Cada molécula de cafeína tem 4 átomos de nitrogênio.
Então, 3,10 x 10²² moléculas * 4 átomos N/molécula ≈ 1,24 x 10²³ átomos de N.
06. (PUC-RJ) A densidade do carbono na forma de diamante é de 3,51 g/cm3. Se você tem um pequeno diamante cujo volume é de 0,027 cm3, quantos moles de carbono ele contém?
- 0,0079 moles
- 0,095 moles
- 10,8 moles
- 1,14 moles
- 0,016 moles
Resposta: A
Resolução:
07. (UFV) A definição de unidade de massa atômica é:
- a massa de um mol de átomos de ¹²C.
- 1/12 da massa de um mol de átomos de ¹²C.
- a massa de um átomo de ¹²C.
- a massa de 1 mg de átomos de ¹²C.
- 1/12 da massa de um átomo de ¹²C.
Resposta: E
Resolução: A unidade de massa atômica (u) é definida como 1/12 da massa de um átomo de carbono-12. Essa fração foi escolhida como padrão para comparar as massas de todos os outros átomos.
08. (UEPB) A mistura de etanol com iodo corresponde ao líquido avermelhado utilizado em alguns termômetros, mas também é muito usado como desinfetante. Qual a massa (g) de etanol que corresponde a 3 mol? C = 12, H = 1, O = 16
- 138
- 46
- 36
- 26
- 32
Resposta: A
Resolução:
09. (Enem 2013) O brasileiro consome em média 500 miligramas de cálcio por dia, quando a quantidade recomendada é o dobro. Uma alimentação balanceada é a melhor decisão para evitar problemas no futuro, como a osteoporose, uma doença que atinge os ossos. Ela se caracteriza pela diminuição substancial de massa óssea, tornando os ossos frágeis e mais suscetíveis a fraturas.
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 × 10²³ mol–1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?
- 7,5 × 1021
- 1,5 × 1022
- 7,5 × 1023
- 1,5 × 1025
- 4,8 × 1025
Resposta: B
Resolução:
10. (UFRGS) Por questões econômicas, a medalha de ouro não é 100% de ouro desde os jogos de 1912 em Estocolmo, e sua composição varia nas diferentes edições dos jogos olímpicos. Para os jogos olímpicos de 2016, no Rio de Janeiro, a composição das medalhas foi distribuída como apresenta o quadro abaixo.
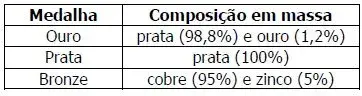
Considerando que as três medalhas tenham a mesma massa, assinale a alternativa que apresenta as medalhas em ordem crescente de número de átomos metálicos na sua composição.
- Medalha de bronze < medalha de ouro < medalha de prata.
- Medalha de bronze < medalha de prata < medalha de ouro.
- Medalha de prata < medalha de ouro < medalha de bronze.
- Medalha de prata < medalha de bronze < medalha de ouro.
- Medalha de ouro < medalha de prata < medalha de bronze.
Resposta: E
Resolução: