Química: Enem 2016
Lista de 17 exercícios de Química com gabarito sobre o tema Química: Enem 2016 com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química: Enem 2016 .
01. (Enem 2016) Os tensoativos são compostos capazes de interagir com substâncias polares e apolares. A parte iônica dos tensoativos interage com substâncias polares, e a parte lipofílica interage com as apolares. A estrutura orgânica de um tensoativo pode ser representada por:

Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
02. (Enem 2016) Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P.; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado)
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
- 1.
- 29.
- 60.
- 170.
- 1 000.
03. (Enem 2016) Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
PLATÃO. Timeu-Crítias. Coimbra: CECH, 2011.
Do ponto de vista da ciência moderna, os “quatro elementos” descritos por Platão correspondem, na verdade, às fases sólida, líquida, gasosa e plasma da matéria. As transições entre elas são hoje entendidas como consequências macroscópicas de transformações sofridas pela matéria em escala microscópica.
Excetuando-se a fase de plasma, essas transformações sofridas pela matéria, em nível microscópico, estão associadas a uma
- troca de átomos entre as diferentes moléculas do material.
- transmutação nuclear dos elementos químicos do material.
- redistribuição de prótons entre os diferentes átomos do material.
- mudança na estrutura espacial formada pelos diferentes constituintes do material.
- alteração nas proporções dos diferentes isótopos de cada elemento presente no material.
04. (Enem 2016) TEXTO I
Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos. Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito extremo at´o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza o acetato como substrato.
AQUINO NETO, S. Preparação e caracterização de bioanodos para biocélula a combustível etanol/O2. Disponível em: www.teses.usp.br. Acesso em: 23 jun. 2015 (adaptado).
TEXTO II
Em sistemas bioeletroquímicos, os potenciais padrão (E°’) apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semirreações de redução e seus respectivos potenciais:
2 CO2 + 7 H+ 8 e- → CH3COO-+2H2O E°’= –0,3 V
O2 + 4H++4 e– → 2H2O E°’ =0,8V
SCOTT, K.; YU, E. H. Microbial electrochemical and fuel cells: fundamentals and applications. Woodhead Publishing Series in Energy in energy n.88,2016(adaptado)
Nessas condições, qual é o número mínimo de biocélulas de acetato, ligadas em série, necessárias para se obter uma diferença de potencial de 4,4 V?
- 3
- 4
- 6
- 9
- 15
05. (Enem 2016) O esquema representa, de maneira simplificada, o processo de produção de etanol utilizando milho como matéria-prima.

A etapa de hidrólise na produção de etanol a partir do milho é fundamental para que
- a glicose seja convertida em sacarose.
- as enzimas dessa planta sejam ativadas.
- a maceração favoreça a solubilização em água.
- o amido seja transformado em substratos utilizáveis pela levedura.
- os grãos com diferentes composições químicas sejam padronizados.
06. (Enem 2016) Os feromônios são substâncias utilizadas na comunicação entre indivíduos de uma espécie. O primeiro feromônio isolado de um inseto foi o bombicol, substância produzida pela mariposa do bicho-da-seda.
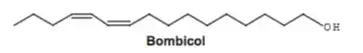
O uso de feromônios em ações de controle de insetos-praga está de acordo com o modelo preconizado para a agricultura do futuro. São agentes altamente específicos e seus compostos químicos podem ser empregados em determinados cultivos, conforme ilustrado no quadro.
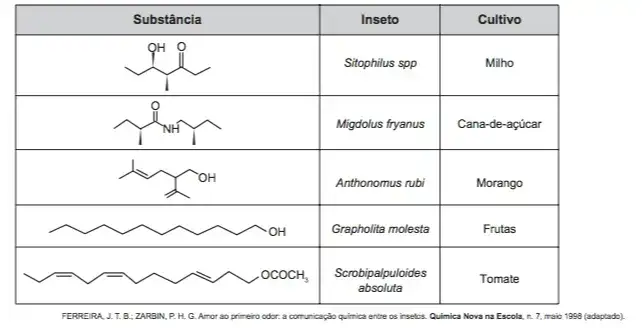
Considerando essas estruturas químicas, o tipo de estereoisomeria apresentada pelo bombicol é também apresentada pelo feromônio utilizado no controle do inseto
- Sitophilus spp.
- Migdolus fryanus.
- Anthonomus rubi.
- Grapholita molesta.
- Scrobipalpuloides absoluta.
07. (Enem 2016) O aquecimento de um material por irradiação com micro-ondas ocorre por causa da interação da onda eletromagnética com o dipolo elétrico da molécula. Um importante atributo do aquecimento por micro-ondas é a absorção direta da energia pelo material a ser aquecido. Assim, esse aquecimento é seletivo e dependerá, principalmente, da constante dielétrica e da frequência de relaxação do material. O gráfico mostra a taxa de aquecimento de cinco solventes sob irradiação de micro-ondas.
No gráfico, qual solvente apresenta taxa média de aquecimento mais próxima de zero, no intervalo de 0 s a 40 s?

- H2O
- CH3OH
- CH3CH2OH
- CH3CH2CH2OH
- CH3CH2CH2CH2CH2CH3
08. (Enem 2016) O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
- Ligações dissulfeto.
- Ligações covalentes.
- Ligações de hidrogênio.
- Interações dipolo induzido – dipolo induzido.
- Interações dipolo permanente – dipolo permanente.
09. (Enem 2016) Em sua formulação, o spray de pimenta contém porcentagens variadas de oleorresina de Capsicum, cujo princípio ativo é a capsaicina, e um solvente (um álcool como etanol ou isopropanol). Em contato com os olhos, pele ou vias respiratórias, a capsaicina causa um efeito inflamatório que gera uma sensação dor e ardor, levando à cegueira temporária. O processo é desencadeado pela liberação de neuropeptídios das terminações nervosas.
Disponível em: http://pessoas.hsw.uol.com.br. Acesso em: 1 mar. 2012 (adaptado).
Quando uma pessoa é atingida com o spray de pimenta nos olhos ou na pele, a lavagem da região atingida com água é ineficaz porque a
- reação entre o etanol e água libera calor, intensificado o ardor.
- solubilidade do princípio ativo em água é muito baixa, dificultando a sua remoção.
- permeabilidade da água na pele é muito alta, nãopermitindo a remoção do princípio ativo.
- solubilização do óleo em água causa um maior espalhamento além das áreas atingidas.
- ardência faz evaporar rapidamente a água, não permitindo que haja contato entre o óleo e o solvente.
10. (Enem 2016) Uma pessoa é responsável pela manutenção de uma sauna úmida. Todos os dias cumpre o mesmo ritual: colhe folhas de capim-cidreira e algumas folhas de eucalipto. Em seguida, coloca as folhas na saída do vapor da sauna, aromatizando-a, conforme representado na figura.

Qual processo de separação é responsável pela aromatização promovida?
- Filtração simples.
- Destilação simples.
- Extração por arraste.
- Sublimação fracionada.
- Decantação sólido-líquido.
11. (Enem 2016) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 (g) → C6H6 (l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ΔHc° = –310 kcal/mol
II. C6H6 (l) + 15/02 O2 (g) → 6 CO2 (g) + 3 H2O (l) ΔHc° = –780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
- –1 090.
- –150.
- –50.
- +157.
- +470.
12. (Enem 2016) Nucleófilos (Nu-) são bases de Lewis que reagem com haletos de alquila, por meio de uma reação chamada substituição nucleofílica (SN), como mostrado no esquema:
R - X + Nu- → R - Nu + X-
(R = grupo alquila e X = halogênio)
A reação de SN entre metóxido de sódio (Nu- = CH3O-) e brometo de metila fornece um composto orgânico pertencente à função
- éter.
- éster.
- álcool.
- haleto.
- hidrocarboneto.
13. (Enem 2016) Pesquisadores recuperaram DNA de ossos de mamute (Mammuthus primigenius) encontrados na Sibéria, que tiveram sua idade de cerca de 28 mil anos confirmada pela técnica do carbono-14
FAPESP. DNA de mamute é revelado. Disponível em: http://agencia.fapesp.br. Acesso em: 13 ago. 2012 (adaptado).
A técnica de datação apresentada no texto só é possível devido à
- proporção conhecida entre carbono-14 e carbono-12 na atmosfera ao longo dos anos.
- decomposição de todo o carbono-12 presente no organismo após a morte.
- fixação maior do carbon-14 nos tecido de organismos após a morte.
- emissão de carbono-12 pelos tecidos de organismos após a morte.
- transformação do carbono-12 em carbono-14 ao longo dos anos.
14. (Enem 2016) A lipofilia é um dos fatores fundamentais para o planejamento de um fármaco. Ela mede o grau de afinidade que a substância tem com ambientes apolares, podendo ser avaliada por seu coeficiente de participação.
Em relação ao coeficiente de participação da testosterona, as lipofilias dos compostos 1 e 2 são, respectivamentes,

- menor e menor que a lipofilia da testosterona.
- menor e maior que a lipofilia da testosterona.
- maior e menor que lipofilia da testosterona.
- maior e maior que a lipofilia da testosterona.
- menor e igual à lipofilia da testosterona.
15. (Enem 2016) Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.
.Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)

- fenol.
- piridina.
- metilamina.
- hidrogenofosfato de potássio.
- hidrogenosulfato de potássio.
16. (Enem 2016) Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCL e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4
TUBINO, M.; SIMONI, J. A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
- liberação de calor.
- alteração da cor para rosa.
- precipitação de um sólido branco.
- formação de gás hidrogênio.
- volatilização de gás cloro.
17. (Enem 2016) A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido com
em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH → CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O =16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de
- 22%.
- 40%.
- 50%.
- 67%
- 75%




