Química: Enem 2014 - Resolução
Lista de 15 exercícios de Química com gabarito sobre o tema Química: Enem 2014 - Resolução com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química: Enem 2014 - Resolução.
01. (Enem 2014) Grande quantidade dos maus odores do nosso dia a dia está relacionada a compostos alcalinos. Assim, em vários desses casos, pode-se utilizar o vinagre, que contém entre 3,5% e 5% de ácido acético, para diminuir ou eliminar o mau cheiro. Por exemplo, lavar as mãos com vinagre e depois enxaguá-las com água elimina o odor de peixe, já que a molécula de piridina (C5H5N) é uma das substâncias responsáveis pelo odor característico de peixe podre.
SILVA, V. A.; BENITE, A. M. C.; SOARES, M. H. F. B. Algo aqui não cheira bem... A química
do mau cheiro. Química Nova na Escola, v. 33, n. 1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
- sobreposição de odor, propiciada pelo cheiro característico do vinagre.
- solubilidade da piridina, de caráter ácido, na solução ácida empregada.
- inibição da proliferação das bactérias presentes, devido à ação do ácido acético.
- degradação enzimática da molécula de piridina, acelerada pela presença de ácido acético.
- reação de neutralização entre o ácido acético e a piridina, que resulta em compostos sem mau odor.
02. (Enem 2014) A utilização de processos de biorremediação de resíduos gerados pela combustão incompleta de compostos orgânicos tem se tornado crescente, visando minimizar a poluição ambiental. Para a ocorrência de resíduos de naftaleno, algumas legislações limitam sua concentração em até 30 mg/kg para solo agrícola e 0,14 mg/L para água subterrânea. A quantificação desse resíduo foi realizada em diferentes ambientes, utilizando-se amostras de 500 g de solo e 100 mL de água, conforme apresentado no quadro.

O ambiente que necessita de biorremediação é o(a)
- solo I.
- solo II.
- água I.
- água II.
- água III.
03. (Enem 2014) O principal processo industrial utilizado na produção de fenol é a oxidação do cumeno (isopropilbenzeno). A equação mostra que esse processo envolve a formação do hidroperóxido de cumila, que em seguida é decomposto em fenol e acetona, ambos usados na indústria química como precursores de moléculas mais complexas. Após o processo de síntese, esses dois insumos devem ser separados para comercialização individual.

Considerando as características físico-químicas dos dois insumos formados, o método utilizado para a separação da mistura, em escala industrial, é a
- filtração.
- ventilação.
- decantação.
- evaporação.
- destilação fracionada.
04. (Enem 2014) Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia de que seja uma protease gástrica, que age no estômago digerindo proteínas. Sabendo que a digestão no estômago é ácida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
- cubo de batata em solução com pH = 9.
- pedaço de carne em solução com pH = 5.
- clara de ovo cozida em solução com pH = 9.
- porção de macarrão em solução com pH = 5.
- bolinha de manteiga em solução com pH = 9.
05. (Enem 2014) A talidomida é um sedativo leve e foi muito utilizado no tratamento de náuseas, comuns no início da gravidez. Quando foi lançada, era considerada segura para o uso de grávidas, sendo administrada como uma mistura racêmica composta pelos seus dois enantiômeros (R e S). Entretanto, não se sabia, na época, que o enantiômero S leva à malformação congênita, afetando principalmente o desenvolvimento normal dos braços e pernas do bebê.
COELHO, F. A. S. Fármacos e quiralidade. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 3, maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses enantiômeros
- reagem entre si.
- não podem ser separados.
- não estão presentes em partes iguais.
- interagem de maneira distinta com o organismo.
- são estruturas com diferentes grupos funcionais.
06. (Enem 2014) Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3 (s) + SO2 (g) → CaSO3 (s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3 (s) + O2 (g) → 2 CaSO4 (s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
- 64.
- 108.
- 122.
- 136.
- 245.
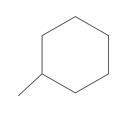
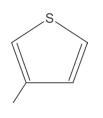
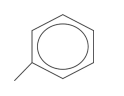
07. (Enem 2014) O estudo de compostos orgânicos permite aos analistas definir propriedades físicas e químicas responsáveis pelas características de cada substância descoberta. Um laboratório investiga moléculas quirais cuja cadeia carbônica seja insaturada, heterogênea e ramificada.
A fórmula que se enquadra nas características da molécula investigada é
- CH3–(CH)2–CH(OH)–CO–NH–CH3.
- CH3–(CH)2–CH(CH3)–CO–NH–CH3.
- CH3–(CH)2–CH(CH3)–CO–NH2.
- CH3–CH2–CH(CH3)–CO–NH–CH3.
- C6H5–CH2–CO–NH–CH3.
08. (Enem 2014) Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0·10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa: CH3COOH, Na2SO4, CH3OH, K2CO3 e NH4Cl.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
- CH3COOH
- Na2SO4
- CH3OH
- K2CO3
- NH4Cl
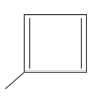
09. (Enem 2014) A forma das moléculas, como representadas no papel, nem sempre é planar. Em um determinado fármaco, a molécula contendo um grupo não planar é biologicamente ativa, enquanto moléculas contendo substituintes planares são inativas.
O grupo responsável pela bioatividade desse fármaco é
10. (Enem 2014) A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)2–3. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.

Das espécies apresentadas, a adequada para essa recuperação é
- Cu (s).
- Pt (s).
- Al3+ (aq).
- Sn (s).
- Zn2+ (aq).
11. (Enem 2014) A capacidade de limpeza e a eficiência de um sabão dependem de sua propriedade de formar micelas estáveis, que arrastam com facilidade as moléculas impregnadas no material a ser limpo. Tais micelas têm em sua estrutura partes capazes de interagir com substâncias polares, como a água, e partes que podem interagir com substâncias apolares, como as gorduras e os óleos.
SANTOS, W. L. P.; MÓL, G. S. (Coords.). Química e sociedade. São Paulo: Nova Geração, 2005 (adaptado).
A substância capaz de formar as estruturas mencionadas é
- C18H36.
- C17H33COONa.
- CH3CH2COONa.
- CH3CH2CH2COOH.
- CH3CH2CH2CH2OCH2CH2CH2CH3.
12. (Enem 2014) Diesel é uma mistura de hidrocarbonetos que também apresenta enxofre em sua composição. Esse enxofre é um componente indesejável, pois o trióxido de enxofre gerado é um dos grandes causadores da chuva ácida. Nos anos 1980, não havia regulamentação e era utilizado óleo diesel com 13 000 ppm de enxofre. Em 2009, o diesel passou a ter 1 800 ppm de enxofre (S1800) e, em seguida, foi inserido no mercado o diesel S500 (500 ppm). Em 2012, foi difundido o diesel S50, com 50 ppm de enxofre em sua composição. Atualmente, é produzido um diesel com teores de enxofre ainda menores. Os impactos da má qualidade do óleo diesel brasileiro.
Disponível em: www.cnt.org.br. Acesso em: 20 dez. 2012 (adaptado).
A substituição do diesel usado nos anos 1980 por aquele difundido em 2012 permitiu uma redução percentual de emissão de SO3 de
- 86,2%
- 96,2%
- 97,2%
- 99,6%
- 99,9%
13. (Enem 2014) O biodiesel não é classificado como uma substância pura, mas como uma mistura de ésteres derivados dos ácido graxos presentes em sua matéria-prima. As propriedades do biodiesel variam com a composição do óleo vegetal ou gordura animal que lhe deu origem, por exemplo, o teor de ésteres saturados é responsável pela maior estabilidade do biodiesel frente à oxidação, o que resulta em aumento da vida útil do biocombustível. O quadro ilustra o teor médio de ácidos graxos de algumas fontes oleaginosas.

Qual das fontes oleaginosas apresentadas produziria um biodiesel de maior resistência à oxidação?
- Milho.
- Palma.
- Canola.
- Algodão.
- Amendoin.
14. (Enem 2014) Para impedir a contaminação microbiana do suprimento de água, deve-se eliminar as emissões de efluentes e, quando necessário, tratá-lo com desinfetante. O ácido hipocloroso (HClO), produzido pela reação entre cloro e água, é um dos compostos mais empregados como desinfetante. Contudo, ele não atua somente como oxidante, mas também como um ativo agente de cloração. A presença de matéria orgânica dissolvida no suprimento de água clorada pode levar à formação de clorofórmio (CHCl3) e outras espécies orgânicas cloradas tóxicas.
SPIRO, T. G.; STIGLIANI, W. M. Química ambiental.
São Paulo: Pearson, 2009 (adaptado).
Visando eliminar da água o clorofórmio e outras moléculas orgânicas, o tratamento adequado é a
- filtração, com o uso de filtros de carvão ativo.
- fluoretação, pela adição de fluoreto de sódio.
- coagulação, pela adição de sulfato de alumínio.
- correção do pH, pela adição de carbonato de sódio.
- floculação, em tanques de concreto com a água em movimento.
15. (Enem 2014) A liberação de gases clorofluorcarbonos (CFCs) na atmosfera pode provocar depleção de ozônio (O3) na estratosfera. O ozônio estratosférico é responsável por absorver parte da radiação ultravioleta emitida pelo Sol, a qual é nociva aos seres vivos. Esse processo, na camada de ozônio, é ilustrado simplificadamente na figura.

Quimicamente, a destruição do ozônio na atmosfera por gases CFCs é decorrência da
- clivagem da molécula de ozônio pelos CFCs para produzir espécies radicalares.
- produção de oxigênio molecular a partir de ozônio, catalisada por átomos de cloro.
- oxidação do monóxido de cloro por átomos de oxigênio para produzir átomos de cloro.
- reação direta entre os CFCs e o ozônio para produzir oxigênio molecular e monóxido de cloro.
- reação de substituição de um dos átomos de oxigênio na molécula de ozônio por átomos de cloro.