Espacial
Lista de 10 exercícios de Química com gabarito sobre o tema Espacial com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Espacial.
01. (Enem 2024) Entre os medicamentos mais comuns consumidos para o alívio da dor está o ibuprofeno, um composto quiral com ação anti-inflamatória e efeito analgésico, que é comercializado como fármaco opticamente puro, ou seja, sem a mistura com outro isômero óptico. A fórmula estrutural plana do ibuprofeno é:

Além do ibuprofeno, destacam-se também os princípios ativos a seguir, presentes em outros medicamentos para o alívio da dor:

O princípio ativo que apresenta o mesmo tipo de isomeria espacial que o ibuprofeno é o(a)
- fenacetina.
- paracetamol.
- dipirona sódica.
- diclofenaco sódico.
- butilbrometo de escopolamina.
02. (Enem 2016) Os feromônios são substâncias utilizadas na comunicação entre indivíduos de uma espécie. O primeiro feromônio isolado de um inseto foi o bombicol, substância produzida pela mariposa do bicho-da-seda.
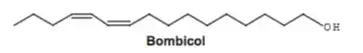
O uso de feromônios em ações de controle de insetos-praga está de acordo com o modelo preconizado para a agricultura do futuro. São agentes altamente específicos e seus compostos químicos podem ser empregados em determinados cultivos, conforme ilustrado no quadro.
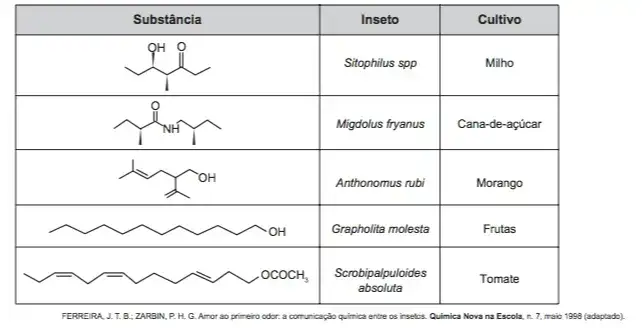
Considerando essas estruturas químicas, o tipo de estereoisomeria apresentada pelo bombicol é também apresentada pelo feromônio utilizado no controle do inseto
- Sitophilus spp.
- Migdolus fryanus.
- Anthonomus rubi.
- Grapholita molesta.
- Scrobipalpuloides absoluta.
03. (Enem 2016 - 3.ª Aplicação) A busca por substâncias capazes de minimizar a ação do inseto que ataca as plantações de tomate no Brasil levou à síntese e ao emprego de um feromônio sexual com a seguinte fórmula estrutural:

Uma indústria agroquímica necessita sintetizar um derivado com maior eficácia. Para tanto, o potencial substituto deverá preservar as seguintes propriedades estruturais do feromônio sexual: função orgânica, cadeia normal e a isomeria geométrica original.
A fórmula estrutural do substituto adequado ao feromônio sexual obtido industrialmente é:
04. (Enem 2014) A talidomida é um sedativo leve e foi muito utilizado no tratamento de náuseas, comuns no início da gravidez. Quando foi lançada, era considerada segura para o uso de grávidas, sendo administrada como uma mistura racêmica composta pelos seus dois enantiômeros (R e S). Entretanto, não se sabia, na época, que o enantiômero S leva à malformação congênita, afetando principalmente o desenvolvimento normal dos braços e pernas do bebê.
COELHO, F. A. S. Fármacos e quiralidade. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 3, maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses enantiômeros
- reagem entre si.
- não podem ser separados.
- não estão presentes em partes iguais.
- interagem de maneira distinta com o organismo.
- são estruturas com diferentes grupos funcionais.
05. (Enem PPL 2017) Em algumas regiões brasileiras, é comum se encontrar um animal com odor característico, o zorrilho. Esse odor serve para a proteção desse animal, afastando seus predadores. Um dos feromônios responsáveis por esse odor é uma substância que apresenta isomeria trans e um grupo tiol ligado à sua cadeia.
A estrutura desse feromônio, que ajuda na proteção do zorrilho, é
06. (Enem 2014) A forma das moléculas, como representadas no papel, nem sempre é planar. Em um determinado fármaco, a molécula contendo um grupo não planar é biologicamente ativa, enquanto moléculas contendo substituintes planares são inativas.
O grupo responsável pela bioatividade desse fármaco é
07. (Enem 2018) Pesquisas demonstram que nanodispositivos baseados em movimentos de dimensões atômicas, induzidos por luz, poderão ter aplicações em tecnologias futuras, substituindo micromotores, sem a necessidade de componentes mecânicos. Exemplo de movimento molecular induzido pela luz pode ser observado pela flexão de uma lâmina delgada de silício, ligado a um polímero de azobenzeno e a um material suporte, em dois comprimentos de onda, conforme ilustrado na figura. Com a aplicação de luz ocorrem reações reversíveis da cadeia do polímero, que promovem o movimento observado.
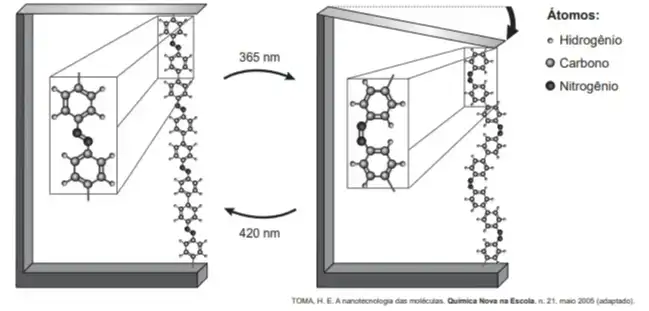
O fenômeno de movimento molecular, promovido pela incidência de luz, decorre do(a)
- movimento vibracional dos átomos, que leva ao encurtamento e à relaxação das ligações.
- isomerização das ligações N = N, sendo a forma cis do polímero mais compacta que a trans.
- tautomerização das unidades monoméricas do polímero, que leva a um composto mais compacto.
- ressonância entre os elétrons π do grupo azo e os do anel aromático que encurta as ligações duplas.
- variação conformacional das ligações N = N, que resulta em estruturas com diferentes áreas de superfície.
08. (Enem PPL 2024) Lentes fotocrômicas escurecem em ambientes externos com alta incidência de luz ultravioleta (UVA), conforme ilustrado. Uma vez na sombra, as lentes se tornam claras novamente.

Em lentes fotocrômicas de plástico, são utilizados corantes orgânicos pertencentes à família dos indenonaftopiranos. Quando o corante fotocrômico (Estrutura 1) é exposto à alta incidência de radiação UVA, uma ligação química é quebrada. A molécula então se rearranja, transformando-se em uma espécie que absorve radiação de comprimento de onda maior (Estrutura 2), fazendo com que a lente escureça.

O escurecimento desse tipo de lente ocorre porque as moléculas de indenonaftopirano
- polimerizam, pela alta incidência de radicais.
- tautomerizam, pela reação no grupo enol.
- polarizam a luz, pela alta energia da luz UVA absorvida.
- oxidam, pela conversão do grupo éter em uma carbonila.
- dispersam a luz, pela ampliação do tamanho da molécula.
09. (Enem PPL 2020) Uma lagarta ao comer as folhas do milho, induz no vegetal a produção de óleos voláteis cujas estruturas estão mostradas a seguir:

A volatilidade desses óleos é decorrência do(a)
- elevado caráter covalente.
- alta miscibilidade em água.
- baixa estabilidade química.
- grande superfície de contato.
- fraca interação intermolecular.
10. (Enem PPL 2024) Uma prática que os brasileiros costumam realizar é a degustação de doces em compotas. O conhecimento popular indica que não é aceitável deixar o mesmo talher usado na degustação e levado à boca dentro da compoteira aberta, em contato com o doce. Essa indicação se deve ao fato de que o doce, no pensamento popular, poderá azedar.
Essa prática popular encontra respaldo no pensamento científico, uma vez que o doce realmente poderá azedar em razão da
- oxidação do doce pelo contato com o ar.
- contaminação por microrganismos, que irão fermentá-lo.
- ação das enzimas salivares que foram transferidas para o doce após a degustação.
- evaporação dos conservantes que mantêm a solução da compota em equilíbrio químico.
- degradação dos componentes doces da compota em reação com compostos químicos do talher.