Cálculo Estequiométrico
Lista de 75 exercícios deQuímicacom gabarito sobre o tema Cálculo Estequiométrico com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o temaCálculo Estequiométrico.
01. (Enem 2025) A química nuclear é uma importante ferramenta na produção de substâncias utilizadas na área da saúde humana. A radiação emitida pelo cobalto-60 é utilizada na medicina como ferramenta de diagnóstico e no tratamento do câncer. No entanto, esse radioisótopo tem um tempo de armazenamento limitado, pois seu tempo de meia-vida é de 5,3 anos. Considere um frasco com uma amostra contendo 2,00 mg de cobalto-60, armazenado durante um período de 26,5 anos.
A massa de cobalto-60, em miligrama, que restará ao final desse tempo é mais próxima de
- 2,00 mg.
- 1,00 mg.
- 0,40 mg.
- 0,13 mg.
- 0,06 mg.
02. (Enem 2025) O Brasil é o maior produtor mundial de nióbio (massa molar = 93 g mol–1), metal utilizado na fabricação de vários tipos de aço: automotivos, estruturais e inoxidáveis. O processo utilizado na produção do nióbio é a redução aluminotérmica de Nb2O5 com excesso de 10% de Al (massa molar = 27 g mol–1), em relação à quantidade estequiométrica da reação, representada pela equação química:
3 Nb2O5(s) + 10 Al(s) → 6 Nb(s) + 5 Al2O3(s)
Uma engenheira metalúrgica estimou a massa de alumínio necessária para produzir 9,3 kg de nióbio, nas condições descritas, para a produção de um lote de peças de aço encomendado por uma indústria, considerando um rendimento de 100%.
Disponível em: www.cbmm.com.br. Acesso em: 17 out. 2015 (adaptado).
A massa de alumínio, em quilograma, estimada pela engenheira é mais próxima de
- 2,7 kg.
- 3,0 kg.
- 4,1 kg.
- 4,5 kg.
- 5,0 kg.
03. (Enem 2025) Apaixonada por culinária e química, uma chefe de cozinha calculou que, para promover o crescimento adequado da massa durante o cozimento de um bolo a 180 ºC (453 K) e 1,00 atm, ela precisaria utilizar uma quantidade de fermento químico suficiente para produzir um volume de gás igual a 4,00 L. Com esse objetivo, ela escolheu utilizar o bicarbonato de amônio, um composto que, sob aquecimento, degrada-se em três gases distintos, que são os responsáveis pelo crescimento da massa. A decomposição do bicarbonato de amônio ocorre conforme a equação química apresentada e, nas condições do cozimento, seu rendimento é de 80%.
NH4HCO3 (s) → NH3 (g) + CO2 (g) + H2O (g)
Considere que a mistura dos gases se comporta como gás ideal nas condições de cozimento utilizadas pela chefe.
Dados: Massa molar do NH4HCO3 = 79 g . mol–1 e R = 0,082 atm . L . mol–1. K–1.
A massa, em grama, de bicarbonato de amônio que ela deve utilizar é mais próxima de
- 2,3 g.
- 3,5 g.
- 5,9 g.
- 6,8 g.
- 8,9 g.
04. (Enem 2022) O etanol é um combustível produzido a partir da fermentação da sacarose presente no caldo de cana-de-açúcar. Um dos fatores que afeta a produção desse álcool é o grau de deterioração da sacarose, que se inicia após o corte, por causa da ação de microrganismos. Foram analisadas cinco amostras de diferentes tipos de cana-de-açúcar e cada uma recebeu um código de identificação. No quadro são apresentados os dados de concentração de sacarose e de microrganismos presentes nessas amostras.

Pretende-se escolher o tipo de cana-de-açúcar que conterá o maior teor de sacarose 10 horas após o corte e que, consequentemente, produzirá a maior quantidade de etanol por fermentação. Considere que existe uma redução de aproximadamente 50% da concentração de sacarose nesse tempo, para cada 1,0 mg L-1 de microrganismos presentes na cana-de-açúcar.
Disponível em: www.Inovacao.unicamp.br. Acesso em: 11 ago. 2012 (adaptado).
Qual tipo de cana-de-açúcar deve ser escolhido?
- RB72
- RB84
- RB92
- SP79
- SP80
05. (Enem PPL 2° Dia 2018) Pesquisadores desenvolveram uma nova e mais eficiente rota sintética para produzir a substância atorvastatina, empregada para reduzir os níveis de colesterol. Segundo os autores, com base nessa descoberta, a síntese da atorvastatina cálcica (CaC₆₆H₆₈F₂N₄O₁₀, massa molar igual a 1154 g/mol) é realizada a partir do éster 4-metil-3-oxopentanoato de metila (C₇H₁₂O₃, massa molar igual a 144 g/mol).
Unicamp descobre nova rota para produzir medicamento mais vendido no mundo. Disponível em: www.unicamp.br. Acesso em: 26 out. 2015 (adaptado).
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de 1 : 1. Simplificadamente, o processo é ilustrado na figura.
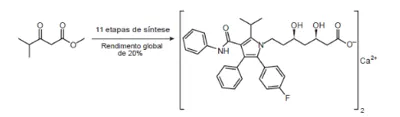
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é mais próxima de
- 20.
- 29.
- 160.
- 202.
- 231.
06. (Enem 1ª Aplicação - 1° Dia 2016) Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P.; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado)
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
- 1.
- 29.
- 60.
- 170.
- 1 000.
07. (Enem PPL 2020) Os esgotos domésticos são, em geral, fontes do íon tripolifosfato (P3O105−, de massa molar igual a 253 g mol−1), um possível constituinte dos detergentes. Esse íon reage com a água, como mostra a equação a seguir, e produz o íon fosfato (PO43−, de massa molar igual a 95 g mol−1), um contaminante que pode causar a morte de um corpo hídrico. Em um lago de 8 000 m3, todo o fósforo presente é proveniente da liberação de esgoto que contém 0,085 mg L−1 de íon tripolifosfato, numa taxa de 16 m3 por dia. De acordo com a legislação brasileira, a concentração máxima de fosfato permitido para água de consumo humano é de 0,030 mg L−1.
P3O105− (aq) + 2 H2O (l) → 3 PO43− (aq) + 4 H+ (aq)
O número de dias necessário para que o lago alcance a concentração máxima de fósforo (na forma de íon fosfato) permitida para o consumo humano está mais próximo de
- 158.
- 177.
- 444.
- 1 258.
- 1 596.
08. (Enem Digital 2020) O reagente conhecido como Kastle-Meyer é muito utilizado por investigadores criminais para detectar a presença de sangue. Trata-se de uma solução aquosa incolor, preparada com zinco metálico, hidróxido de sódio (Reação 1) e indicador (Reação 2). Essa solução, quando em contato com a hemoglobina contida no sangue e na presença de água oxigenada (Reação 3), passa de incolor para vermelha, indicando a presença de sangue no local, conforme as reações descritas.
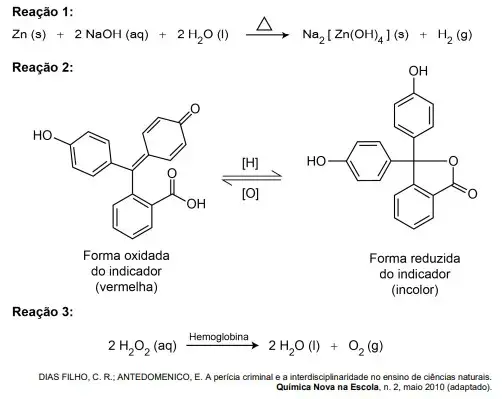
A mudança de coloração que indica a presença de sangue ocorre por causa da reação do indicador com o(a)
- sal de Na2[Zn(OH)4] na presença de hemoglobina.
- água produzida pela decomposição da água oxigenada.
- hemoglobina presente na reação com a água oxigenada.
- gás oxigênio produzido pela decomposição da água oxigenada.
- gás hidrogênio produzido na reação do zinco com hidróxido de sódio.
09. (Enem PPL 1° Dia 2015) O álcool utilizado como combustível automotivo (etanol hidratado) deve apresentar uma taxa máxima de água em sua composição para não prejudicar o funcionamento do motor. Uma maneira simples e rápida de estimar a quantidade de etanol em misturas com água é medir a densidade da mistura. O gráfico mostra a variação da densidade da mistura (água e etanol) com a fração percentual da massa de etanol (fe), dada pela expressão fe = me/(me + ma), em que me e ma são as massas de etanol e de água na mistura, respectivamente, a uma temperatura de 20 °C.

Suponha que, em uma inspeção de rotina realizada em determinado posto, tenha-se verificado que 50,0 cm3 de álcool combustível tenham massa igual a 45,0 g.
Qual é a fração percentual de etanol nessa mistura?

- 7%
- 10%
- 55%
- 90%
- 93%
10. (Enem PPL 1° Dia 2014) O álcool comercial (solução de etanol) é vendido na concentração de 96%, em volume. Entretanto, para que possa ser utilizado como desinfetante, deve-se usar uma solução alcoólica na concentração de 70%, em volume. Suponha que um hospital recebeu como doação um lote de 1 000 litros de álcool comercial a 96%, em volume, e pretende trocá-lo por um lote de álcool desinfetante.
Para que a quantidade total de etanol seja a mesma nos dois lotes, o volume de álcool a 70% fornecido na troca deve ser mais próximo de
- 1 042 L.
- 1 371 L.
- 1 428 L.
- 1 632 L.
- 1 700 L.
11. (Enem PPL 1° Dia 2014) Os bafômetros (etilômetros) indicam a quantidade de álcool, C2H6O (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:

Na reação global de funcionamento do bafômetro, os reagentes e os produtos desse tipo de célula são
- o álcool expirado como reagente; água, elétrons e H+ como produtos.
- o oxigênio do ar e H+ como reagentes; água e elétrons como produtos.
- apenas o oxigênio do ar como reagente; apenas os elétrons como produto.
- apenas o álcool expirado como reagente; água, C2H4O e H+ como produtos.
- o oxigênio do ar e o álcool expirado como reagentes; água e C2H4O como produtos.
12. (Enem 2012) Aspartame é um edulcorante artificial (adoçante dietético) que apresenta potencial adoçante 200 vezes maior que o açúcar comum, permitindo seu uso em pequenas quantidades. Muito usado pela indústria alimentícia, principalmente nos refrigerantes diet, tem valor energético que corresponde a 4 calorias/grama. É contraindicado a portadores de fenilcetonúria, uma doença genética rara que provoca o acúmulo da fenilalanina no organismo, causando retardo mental. O IDA (índice diário aceitável) desse adoçante é 40 mg/kg de massa corpórea.
Disponível em: http://boaspraticasfarmaceuticas.blogspot.com. Acesso em: 27 fev. 2012.
Com base nas informações do texto, a quantidade máxima recomendada de aspartame, em mol, que uma pessoa de 70 kg de massa corporal pode ingerir por dia é mais próxima de
Dado: massa molar do aspartame = 294 g/mol
- 1,3 × 10–4.
- 9,5 × 10–3.
- 4 × 10–2.
- 2,6.
- 823.
13. (Enem PPL 2023) Um carro sedã apresenta tipicamente 200 kg de alumínio distribuídos pelo chassi, motor e cabine. Uma amostra de bauxita, principal fonte natural do metal, é composta por 50% em massa de óxido de alumínio (Al2O3). Considere a massa molar do alumínio (Al) igual a 27 g mol−1 e a do oxigênio (O) igual a 16 g mol−1.
A massa de bauxita que deve ser empregada para produzir o alumínio usado na fabricação de um carro desse modelo é mais próxima de
- 378 kg.
- 400 kg.
- 637 kg.
- 756 kg.
- 1 512 kg.
14. (Enem 2006) Para se obter 1,5 kg do dióxido de urânio puro, matéria-prima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério. Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de
- 0,10%.
- 0,15%.
- 0,20%.
- 1,5%.
- 2,0%.
15. (Enem PPL 2018) Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha. A reação não balanceada que ocorre é:
Ag2S (s) + Al(s) → Al2S3 (s) + Ag (s)
Dados da massa molar dos elementos (g mol-1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral, orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
- 0,54 g.
- 1,08 g.
- 1,91 g.
- 2,16 g.
- 3,82 g.
16. (Enem PPL 2018) As indústrias de cerâmica utilizam argila para produzir artefatos como tijolos e telhas. Uma amostra de argila contém 45% em massa de sílica (SiO2) e 10% em massa de água (H2O). Durante a secagem por aquecimento em uma estufa, somente a umidade é removida.
Após o processo de secagem, o teor de sílica na argila seca será de
- 45%.
- 50%.
- 55%.
- 90%.
- 100%.
17. (Enem PPL 2° Dia 2018) As soluções de hipoclorito de sódio têm ampla aplicação como desinfetantes e alvejantes. Em uma empresa de limpeza, o responsável pela área de compras deve decidir entre dois fornecedores que têm produtos similares, mas com diferentes teores de cloro.
Um dos fornecedores vende baldes de 10 kg de produto granulado, contendo 65% de cloro ativo, a um custo de R$ 65,00. Outro fornecedor oferece, a um custo de R$ 20,00, bombonas de 50 kg de produto líquido contendo 10% de cloro ativo.
Considerando apenas o quesito preço por kg de cloro ativo e desprezando outras variáveis, para cada bombona de 50 kg haverá uma economia de
- R$ 4,00.
- R$ 6,00.
- R$ 10,00.
- R$ 30,00.
- R$ 45,00.
18. (Enem LIBRAS 2017) A ingestão de vitamina C (ou ácido ascórbico; massa molar igual a 176 g/mol) é recomendada para evitar o escorbuto, além de contribuir para a saúde de dentes e gengivas e auxiliar na absorção de ferro pelo organismo. Uma das formas de ingerir ácido ascórbico é por meio dos comprimidos efervescentes, os quais contêm cerca de 0,006 mol de ácido ascórbico por comprimido. Outra possibilidade é o suco de laranja, que contém cerca de 0,07 g de ácido ascórbico para cada 200 mL de suco.
O número de litros de suco de laranja que corresponde à quantidade de ácido ascórbico presente em um comprimido efervescente é mais próximo de
- 0,002.
- 0,03.
- 0,3.
- 1.
- 3.
19. (Enem PPL 2° Dia 2017) No Brasil, os postos de combustíveis comercializavam uma gasolina com cerca de 22% de álcool anidro. Na queima de 1 litro desse combustível são liberados cerca de 2 kg de CO2 na atmosfera. O plantio de árvores pode atenuar os efeitos dessa emissão de CO2. A quantidade de carbono fixada por uma árvore corresponde a aproximadamente 50% de sua biomassa seca, e para cada 12 g de carbono fixados, 44 g de CO2 são retirados da atmosfera. No brasil, o plantio de eucalípto (Eucalyptus grandis) é bem difundido, sendo que após 11 anos essa árvore pode ter a massa de 106 kg, dos quais 29 kg são água.
Uma única árvore de Eucalyptus grandis, com as características descritas, é capaz de fixar a quantidade de CO2 liberada na queima de um volume dessa gasolina mais próxima de
- 19 L.
- 39 L.
- 71 L.
- 97 L.
- 141 L.
20. (Enem PPL 2017) Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.

Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
- etano.
- butano.
- metano.
- propano.
- acetileno.
21. (Enem 2017) A toxicidade de algumas substâncias é normalmente representada por um índice conhecido como DL50 (dose letal mediana). Ele representa a dosagem aplicada a uma população de seres vivos que mata 50% desses indivíduos e é normalmente medido utilizando-se ratos como cobaias. Esse índice é muito importante para os seres humanos, pois ao se extrapolar os dados obtidos com o uso de cobaias, pode-se determinar o nível tolerável de contaminação de alimentos, para que possam ser consumidos de forma segura pelas pessoas. O quadro apresenta três pesticidas e suas toxicidades. A unidade mg/kg indica a massa da substância ingerida pela massa da cobaia.

Sessenta ratos, com massa de 200 g cada, foram divididos em três grupos de vinte. Três amostras de ração, contaminadas, cada uma delas com um dos pesticidas indicados no quadro, na concentração de 3 mg por grama de ração, foram administradas para cada grupo de cobaias. Cada rato consumiu 100 g de ração.
Qual(ais) grupo(s) terá(ão) uma mortalidade mínima de 10 ratos?
- O grupo que se contaminou somente com atrazina.
- O grupo que se contaminou somente com diazinon.
- Os grupos que se contaminaram com atrazina e malation.
- Os grupos que se contaminaram com diazinon e malation.
- Nenhum dos grupos contaminados com atrazina, diazinon e malation.
22. (Enem PPL 2014) O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + O2 (g) → 2 Cu (s) + SO2 (g), é possível obtê-lo na forma metálica.
A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é
- 1,0 × 103 mol.
- 5,0 × 102 mol.
- 1,0 × 100 mol.
- 5,0 × 10−1 mol.
- 4,0 × 10−3 mol.
23. (Enem 2017) O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:

Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto.
Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
- 293
- 345
- 414
- 690
- 828
24. (Enem 3ª 2016) As emissões de dióxido de carbono (CO2) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2, a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15 km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
- 24 kg.
- 33 kg.
- 40 kg.
- 88 kg.
- 147 kg.
25. (Enem 3ª Aplicação) A obtenção de energia por meio da fissão nuclear do 235U é muito superior quando comparada à combustão da gasolina. O calor liberado na fissão do 235U é 8 × 1010 J/g e na combustão da gasolina é 5 × 104 J/g.
A massa de gasolina necessária para obter a mesma energia na fissão de 1 kg de 235U é da ordem
- 103 g.
- 104 g.
- 105 g.
- 106 g.
- 109 g.
26. (Enem PPL 1° Dia 2016) As emissões de dióxido de carbono (CO2) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2, a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15 km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
- 24 kg.
- 33 kg.
- 40 kg.
- 88 kg.
- 147 kg.
27. (Enem 2016) A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como:
R = (número de mols do produto obtido / número de mols do produto esperado pela estequiometria) × 100%
O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH → CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de
- 22%.
- 40%.
- 50%.
- 67%.
- 75%.
28. (Enem 2015) A hidroponia pode ser definida como uma técnica de produção de vegetais sem necessariamente a presença de solo. Uma das formas de implementação é manter as plantas com suas raízes suspensas em meio líquido, de onde retiram os nutrientes essenciais. Suponha que um produtor de rúcula hidropônica precise ajustar a concentração do íon nitrato (NO3-) para 0,009 mol/L em um tanque de 5 000 litros e, para tanto, tem em mãos uma solução comercial nutritiva de nitrato de cálcio 90 g/L. As massas molares dos elementos N, O e Ca são iguais a 14 g/mol, 16 g/mol e 40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva, em litros, que o produtor deve adicionar ao tanque?
- 26
- 41
- 45
- 51
- 82
29. (Enem PPL 2014) O bisfenol-A é um composto que serve de matéria-prima para a fabricação de polímeros utilizados em embalagens plásticas de alimentos, em mamadeiras e no revestimento interno de latas. Esse composto está sendo banido em diversos países, incluindo o Brasil, principalmente por ser um mimetizador de estrógenos (hormônios) que, atuando como tal no organismo, pode causar infertilidade na vida adulta. O bisfenol-A (massa molar igual a 228 g/mol) é preparado pela condensação da propanona (massa molar igual a 58 g/mol) com fenol (massa molar igual a 94 g/mol), em meio ácido, conforme apresentado na equação química.

Considerando que, ao reagir 580 g de propanona com 3 760 g de fenol, obteve-se 1,14 kg de bisfenol-A, de acordo com a reação descrita, o rendimento real do processo foi de
- 0,025%
- 0,05%
- 12,5%
- 25%
- 50%
30. (Enem PPL 2014) Em um caso de anemia, a quantidade de sulfato de ferro(II) (FeSO4, massa molar igual a 152 g/mol) recomendada como suplemento de ferro foi de 300 mg/dia. Acima desse valor, a mucosa intestinal atua como barreira, impedindo a absorção de ferro. Foram analisados cinco frascos de suplemento, contendo solução aquosa de FeSO4, cujos resultados encontram-se no quadro.

Se for ingerida uma colher (10 mL) por dia do medicamento para anemia, a amostra que conterá a concentração de sulfato de ferro(II) mais próxima da recomendação é a do frasco de número
- 1.
- 2.
- 3.
- 4.
- 5.
31. (Enem PPL 2014) A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde o Ca(OH)2 em excesso e Al2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas. Após a decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, Al, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de Al2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
- 59 g.
- 493 g.
- 987 g.
- 1 480 g.
- 2 960 g.
32. (Enem PPL 2014) Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3 (s) + SO2 (g) → CaSO3 (s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3 (s) + O2 (g) → 2 CaSO4 (s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
- 64.
- 108.
- 122.
- 136.
- 245.
33. (Enem 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém cerca de 3,3% de carbono. Uma forma de eliminar o excesso de carbono é a oxidação a partir do aquecimento do ferro-gusa com gás oxigênio puro. Os dois principais produtos formados são aço doce (liga de ferro com teor de 0,3% de carbono restante) e gás carbônico. As massas molares aproximadas dos elementos carbono e oxigênio são, respectivamente, 12 g/mol e 16 g/mol.
LEE, J. D. Química Inorgânica não tão concisa. São Paulo: Edgard Blucher, 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
- 28.
- 75.
- 175.
- 275.
- 303.
34. (Enem 2013) O brasileiro consome em média 500 miligramas de cálcio por dia, quando a quantidade recomendada é o dobro. Uma alimentação balanceada é a melhor decisão para evitar problemas no futuro, como a osteoporose, uma doença que atinge os ossos. Ela se caracteriza pela diminuição substancial de massa óssea, tornando os ossos frágeis e mais suscetíveis a fraturas.
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 × 1023 mol-1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual é a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?
- 7,5 × 1021
- 1,5 × 1022
- 7,5 × 1023
- 1,5 × 1025
- 4,8 × 1025
35. (Enem PPL 2012) Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64
- 2,2 g.
- 2,8 g.
- 3,7 g.
- 4,4 g.
- 5,5 g.
36. (Enem PPL 1° Dia 2011) Três amostras de minérios de ferro de regiões distintas foram analisadas e os resultados, com valores aproximados, estão na tabela:

Os minérios que apresentam, respectivamente, a maior pureza e o menor consumo de carvão por tonelada de ferro produzido são os das regiões:
- A com 75% e C com 143 kg.
- B com 80% e A com 161 kg.
- C com 85% e B com 107 kg.
- A com 90% e B com 200 kg.
- B com 95% e A com 161 kg.
37. (Enem 2010) As mobilizações para promover um planeta melhor para as futuras gerações são cada vez frequentes. A maior parte dos meios de transporte de massa é atualmente movida pela queima de um combustível fóssil. A título de exemplificação do ônus causado por essa prática, basta saber que um carro produz, em média, cerca de 200g de dióxido de carbono por km percorrido.
Revista Aquecimento Global. Ano 2, n° 8. Publicação do Instituto Brasileiro de Cultura Ltda.
Um dos principais constituintes da gasolina é o octano (C8H18). Por meio da combustão do octano é possível a liberação da energia, permitindo que o carro entre em movimento. A equação que representa a reação química desse processo demonstra que
- no processo há liberação de oxigênio, sob a forma de O2.
- o coeficiente estequiométrico para a água é de 8 para 1 do octano.
- no processo há consumo de água, para que haja liberação de energia.
- o coeficiente estequiométrico para o oxigênio é de 12,5 para 1 do octano.
- o coeficiente estequiométrico para o gás carbônico é de 9 para 1 do octano.
38. (Enem 2010) A composição média de uma bateria automotiva esgotada é de aproximadamente 32% Pb, 3% PbO, 17% PbO2 e 36% PbSO4. A média de massa da pasta residual de uma bateria usada é de 6 kg, onde 19% é PbO2, 60% PbSO4 e 21% Pb. Entre todos os compostos de chumbo presentes na pasta, o que mais preocupa é o sulfato de chumbo (II), pois nos processos pirometalúrgicos, em que os compostos de chumbo (placas das baterias) são fundidos, há a conversão de sulfato em dióxido de enxofre, gás muito poluente.
Para reduzir o problema das emissões de SO2(g), a indústria pode utilizar uma planta mista, ou seja, utilizar o processo hidrometalúrgico, para a dessulfuração antes da fusão do composto de chumbo. Nesse caso, a redução de sulfato presente no PbSO4 é feita via lixiviação com solução de carbonato de sódio (Na2CO3) 1M a 45 ºC, em que se obtém o carbonato de chumbo (II) com rendimento de 91%. Após esse processo, o material segue para a fundição para obter o chumbo metálico.

Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual a quantidade aproximada, em quilogramas, de PbCO3 é obtida?
- 1,7 kg
- 1,9 kg
- 2,9 kg
- 3,3 kg
- 3,6 kg
39. (Enem 2021) Os pesticidas organoclorados foram amplamente empregados na agricultura, contudo, em razão das suas elevadas toxicidades e persistências no meio ambiente, eles foram banidos. Considere a aplicação de 500 g de um pesticida organoclorado em uma cultura e que, em certas condições, o tempo de meia-vida do pesticida no solo seja de 5 anos.
A massa do pesticida no decorrer de 35 anos será mais próxima de
- 3,9 g.
- 31,2 g.
- 62,5 g.
- 125,0 g.
- 250,0 g.
40. (Enem 2021) Um técnico analisou um lote de analgésicos que supostamente estava fora das especificações. A composição prevista era 100 mg de ácido acetilsalicílico por comprimido (princípio ativo, cuja estrutura está apresentada na figura), além do amido e da celulose (componentes inertes). O técnico realizou os seguintes testes:
1) obtenção da massa do comprimido;
2) medição da densidade do comprimido;
3) verificação do pH com papel indicador;
4) determinação da temperatura de fusão do comprimido;
5) titulação com solução aquosa de NaOH.
Após a realização dos testes, o lote do medicamento foi reprovado porque a quantidade de ácido acetilsalicílico por comprimido foi de apenas 40% da esperada.

O teste que permitiu reprovar o lote de analgésicos foi o de número
- 1.
- 2.
- 3.
- 4.
- 5.
41. (Enem 2021) A obtenção de etanol utilizando a cana-de-açúcar envolve a fermentação dos monossacarídeos formadores da sacarose contida no melaço. Um desses formadores é a glicose (C6H12O6), cuja fermentação produz cerca de 50 g de etanol a partir de 100 g de glicose, conforme a equação química descrita.

Em uma condição específica de fermentação, obtém-se 80% de conversão em etanol que, após sua purificação, apresenta densidade igual a 0,80 g/mL. O melaço utilizado apresentou 50 kg de monossacarídeos na forma de glicose.
O volume de etanol, em litro, obtido nesse processo é mais próximo de
- 16.
- 20.
- 25.
- 64.
- 100.
42. (Enem 2020) A sacarase (ou invertase) é uma enzima que atua no intestino humano hidrolisando o dissacarídeo sacarose nos monossacarídeos glicose e frutose. Em um estudo cinético da reação de hidrólise da sacarose (C12H22O11). foram dissolvidos 171 g de sacarose em 500 mL de água. Observou-se que, a cada 100 minutos de reação, a concentração de sacarose foi reduzida à metade, qualquer que fosse o momento escolhido como tempo inicial. As massas molares dos elementos H, C e O são iguais a 1, 12 e 16 g mol-1, respectivamente.
Qual é a concentração de sacarose depois de 400 minutos do início da reação de hidrólise?
- 2,50 × 10-3 mol L-1
- 6,25 × 10-2 mol L-1
- 1,25 × 10-1 mol L-1
- 2,50 × 10-1 mol L-1
- 4,27 × 10-1 mol L-1
43. (Enem 2020) O crescimento da frota de veículos em circulação no mundo tem levado à busca e desenvolvimento de tecnologias que permitam minimizar emissões de poluentes atmosféricos. O uso de veículos elétricos é uma das propostas mais propagandeadas por serem de emissão zero. Podemos comparar a emissão de carbono na forma de CO2 (massa molar igual a 44 g mol-1) para os dois tipos de carros (a combustão e elétrico). Considere que os veículos tradicionais a combustão, movidos à etanol (massa molar igual a 46 g mol-1), emitem uma média de 2,6 mol de CO2 por quilômetro rodado, e os elétricos emitem o equivalente a 0,45 mol de CO2 por quilômetro rodado (considerando as emissões na geração e transmissão da eletricidade). A reação de combustão do etanol pode ser representada pela equação química:
C2H5OH (l) + 3O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas em dois veículos, um movido a etanol e outro elétrico, em um mesmo trajeto de 1 000 km.
CHIARADIA C A Estudo da viabilidade da implantação de frotas de veículos elétricos e hibridos elétricos no atua! cenário econômico, político, energético e ambiente! brasileiro. Guaratinguetá Unesp, 2015 (adaptado).
A quantidade equivalente de etanol economizada, em quilograma, com o uso do veiculo elétrico nesse trajeto, é mais próxima de
- 50.
- 60.
- 95.
- 99.
- 120.
44. (Enem PPL 2021) O consumo excessivo de sal de cozinha é responsável por várias doenças, entre elas a hipertensão arterial. O sal rosa é uma novidade culinária pelo seu baixo teor de sódio se comparado a de outros sais. Cada 1 g desse sal contém cerca de 230 mg de sódio contra os cerca de 400 mg de sódio encontrados nessa mesma quantidade de um sal de cozinha tradicional. Estima-se que no Brasil a dose diária de consumo de sal de cozinha seja de 12g e a dose máxima recomendada é de menos de 5 g por dia. Considere a massa molar do sódio igual a 23 g/mol.
MILL, J. G. et al. Estimativa do consumo de sal pela população brasileira: resultado da Pesquisa Nacional de Saúde 2013. Rev. Bras. Epidemiol., n. 22, 2019 (adaptado).
Considerando-se a dose estimada de consumo de sal de cozinha no Brasil, em 30 dias um indivíduo que substituir o sal de cozinha tradicional pelo sal rosa promove uma redução na quantidade de sódio ingerida, em mol, mais próxima de
- 1,1.
- 2,7.
- 3,6.
- 6,3.
- 9,9.
45. (Enem PPL 2021) Um marceneiro esqueceu um pacote de pregos ao relento, expostos à umidade do ar e à chuva. Com isso, os pregos de ferro, que tinham a massa de 5,6 g cada, acabaram cobertos por uma camada espessa de ferrugem (Fe2O3·H2O), uma substância marron insolúvel, produto da oxidação do ferro metálico, que ocorre segundo a equação química:
2 Fe(s)+ 3/2 O2 (g) + H2O (I) → Fe2O3·H2O (s)
Considere as massas molares (g/mol): H = 1; O = 16; Fe = 56.
Qual foi a massa de ferrugem produzida ao se oxidar a metade (50%) de um prego?
- 4,459
- 8,909
- 17,809
- 72,009
- 144,009
46. (Enem PPL 2021) A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reagem formando umasolução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:
4FeS2(s) + 15O2(g) + H2O(I) — 2 Fe2(SO4)3(aq) + H2SO4(ag)
Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol, respectivamente?
- 0,2
- 5,0
- 10,0
- 20,0
- 200,0
47. (Enem PPL 2021) As plantas realizam fotossíntese pela captura do gás carbônico atmosférico e, juntamente com a água e a luz solar, produzem os carboidratos. No esquema está apresentada a equação desse processo, em que as letras xe y representam os coeficientes estequiométricos da reação

Quais são os valores dos coeficientes x e y da equação balanceada de produção do carboidrato e oxigênio?
- x-7n;y-20n
- x-10n;y-8n
- x-10n;y=14n
- x-12n;y=10n
- x-14n;y-6n
48. (Enem 2024) O biogás é uma alternativa energética muito importante, pois, além de reduzir a dependência por combustíveis fósseis, sua obtenção pode ser realizada a partir de resíduos da produção agroindustrial. Considere que o biogás produzido em um empreendimento de suinocultura contém 70% em volume de metano (massa molar 16 g/mol; volume molar 22 L/mol). Ele será utilizado para geração de energia em substituição ao etanol (massa molar 46 g/mol) em um gerador no qual 1 m³ de biogás de origem suína substitui 0,59 L de etanol anidro (densidade 0,78 g/mL).
Nessas condições, a massa de metano necessária para substituir 10 mol de etanol na produção de energia é mais próxima de
- 300 g.
- 400 g.
- 510 g.
- 590 g.
- 720 g.
49. (Enem 2024) O soro caseiro serve para combater a desidratação por meio da reposição da água e sais minerais perdidos, por exemplo, por diarreia. Uma receita simples para a sua preparação consiste em utilizar duas colheres grandes (de sopa) de açúcar e duas colheres pequenas (de café) de sal de cozinha, dissolvidos em 2 L de água fervida, obtendo-se uma solução com concentração de íon sódio de 1,4 mg/mL.
Considere as massas molares: NaCl = 58,5 g/mol; Na = 23 g/mol.
Qual é o valor mais próximo da massa, em grama, de cloreto de sódio presente em uma única colher pequena?
- 0,7 g
- 1,8 g
- 2,8 g
- 3,6 g
- 7,0 g
50. (Enem 2023) Existe no comércio um produto antimofo constituído por uma embalagem com tampa perfurada contendo cloreto de cálcio anidro, CaCl2. Uma vez aberto o lacre, essa substância absorve a umidade ambiente, transformando-se em cloreto de cálcio di-hidratado, CaCl2•2H2O.
Considere a massa molar da água igual a 18 g mol-1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol-1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
- 14%
- 16%
- 24%
- 32%
- 75%
51. (Enem 2023) Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio(II) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg2(NO3)2 dissolvidos em água. Temendo a toxicidade do mercúrio e sabendo que o Hg2Cl2 tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Hg2(NO3)2 (aq) + 2 NaCl (aq) → Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.


O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. o assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCI adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2(NO3)2 é 525 g mol-1, a do NaCl é 58 g mol-1 e a do Hg2Cl2 é 472 g mol-1.
Qual foi o gráfico obtido pelo assistente de laboratório?
52. (Enem 2022) O elemento iodo (l) tem função biológica e é acumulado na tireoide. Nos acidentes nucleares de Chernobyl e Fukushima, ocorreu a liberação para a atmosfera do radioisótopo 131l responsável por enfermidades nas pessoas que foram expostas a ele. O decaimento de uma massa de 12 microgramas do isótopo 131l foi monitorado por 14 dias, conforme e quadro.

Após o período de 40 dias, a massa residual desse isótopo é mais próxima de
- 2,4 µg.
- 1,5 µg.
- 0,8 µg.
- 0,4 µg.
- 0,2 µg.
53. (Enem 2022) O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol L-1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação é representada pela equação química

A concentração de ácido tartárico no vinho analisado é mais próxima de:
- 1,8 g L-1
- 2,4 g L-1
- 3,6 g L-1
- 4,8 g L-1
- 9,6 g L-1
54. (Enem PPL 2024) O titânio é encontrado na natureza em minerais, dos quais o rutilo (TiO2) está presente na principal mina do Brasil, localizada no Rio Grande do Norte. Para obtenção do titânio metálico, o TiO2 é submetido a duas operações industriais. A primeira consiste na cloração, produzindo tetracloreto de titânio, conforme a equação:
TiO2 + 2 Cl2 + 2 CO TiCI4 + 2 CO2
A segunda operação consiste na redução do tetracloreto de titânio, utilizando magnésio metálico:
2 Mg + TiCl4 2 MgCl2 + Ti
Considere as massas molares:
Cl = 35,5 g/mol ; Ti = 48 g/mol .
Qual a massa de gás cloro necessária para produzir 480 kg de titânio metálico?
- 179 kg
- 359 kg
- 480 kg
- 710 kg
- 1 420 kg
55. (Enem PPL 2024) A hipertensão arterial é um problema de saúde que se agrava pelo crescente consumo de sal rico em sódio. O consumo máximo diário recomendado pelo Ministério da Saúde é de, aproximadamente, 5 g de NaCl. No entanto, os brasileiros consomem em média 12 g desse sal por dia. Por isso, a indústria lançou no mercado o chamado sal light, que apresenta um teor reduzido de cloreto de sódio. Sua composição é cerca de 50% de NaCl e 50% de KCl, em massa.
Massas molares:
Na = 23 g/mol; Cl = 35,5 g/mol; K = 39 g/mol
Pesquisa de orçamentos familiares: análise do consumo alimentar pessoal no Brasil. Disponível em: www.biblioteca.ibge.gov.br. Acesso em: 27 nov. 2019 (adaptado).
Ainda que os brasileiros consumam apenas sal light, a massa de sódio ingerida em excesso será mais próxima de
- 0,4 g.
- 1,0 g.
- 1,4 g.
- 2,8 g.
- 3,5 g.
56. (Enem PPL 2023) Com o objetivo de demonstrar a transferência de energia de um sistema para outro, um professor solicitou a seus alunos que determinassem o calor de combustão de alguns alimentos e, para auxiliar nessa tarefa, forneceu um quadro que apresenta cinco alimentos identificados por números e seus respectivos calores de combustão.

Posteriormente, entregou uma amostra de 0,5 g de um alimento indeterminado a um dos estudantes, que realizou o seguinte procedimento experimental: colocou 4 mL de água em um tubo de ensaio e mediu a temperatura, encontrando 20 °C. Em seguida, o estudante queimou o alimento recebido, abaixo do tubo de ensaio contendo a água, o que elevou a temperatura da água para 50 °C. Considere que, nas condições do experimento, a perda de calor para o ambiente é desprezível e o calor específico da água e sua densidade são, respectivamente, 1 cal/(g °C) e 1 g/mL.
Qual alimento do quadro o estudante recebeu do professor?
- I
- II
- III
- IV
- V
57. (Enem PPL 2017) O ferro metálico é obtido em altos-fornos pela mistura do minério hematita (d-Fe203) contendo impurezas, coque (C) e calcário (CaCO3), sendo estes mantidos sob um fluxo de ar quente que leva a queima do coque, com a temperatura no alto-forno chegando próximo a 2 000 ºC. As etapas caracterizam o processo em função da temperatura.

No processo de redução desse metal, o agente redutor é o
- C.
- CO.
- CO2.
- CaO.
- CaCO3.
58. (Enem 2016) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 (g) → C6H6 (l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ΔHc° = –310 kcal/mol
II. C6H6 (l) + 15/02 O2 (g) → 6 CO2 (g) + 3 H2O (l) ΔHc° = –780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
- –1 090.
- –150.
- –50.
- +157.
- +470.
59. (Enem 2016 - 3.ª Aplicação) Climatério é o nome de um estágio no processo de amadurecimento de determinados frutos, caracterizado pelo aumento do nível da respiração celular e do gás etileno (C2H4). Como consequência, há o escurecimento do fruto, o que representa a perda de muitas toneladas de alimentos a cada ano.
É possível prolongar a vida de um fruto climatérico pela eliminação do etileno produzido. Na indústria, utiliza-se o permanganato de potássio (KMn04) para oxidar o etileno a etilenoglicol (HOCH2CH2OH), sendo o processo representado de forma simplificada na equação:
2KMnO4 + 3C2H4 + 4H2O → 2MnO2 + 3HOCH2CH2OH + 2KOH
O processo de amadurecimento começa quando a concentração de etileno no ar está em cerca de 1,0 mg de C2H4 por kg de ar.
As massa molares dos elementos H, C, O, K e Mn são, respectivamente, iguais a 1 g/mol, 12 g/mol, 16 g/mol, 39 g/mol e 55 g/mol.
A fim de diminuir essas perdas, sem desperdício de reagentes, a massa mínima de KMnO4 por kg de ar é mais próxima de
- 0,7 mg.
- 1,0 mg.
- 3,8 mg.
- 5,6 mg.
- 8,5 mg.
60. (Enem 2016 - 3.ª Aplicação) Um bafômetro simples consiste em um tubo contendo uma mistura sólida de dicromato de potássio em sílica umedecida com ácido sulfúrico. Nesse teste, a detecção da embriaguez por consumo de álcool se dá visualmente, pois a reação que ocorre é a oxidação do álcool a aldeído e a redução do dicromato (alaranjado) a cromo (III) (verde) ou cromo (II) (azul).

A equação balanceada da reação química que representa esse teste é
- Cr2O72− (aq) + 2 H+ (aq) + 3 CH3–CH2–OH (g) → 2 Cr2+ (aq) + 4 H2O (l) + 3 CH3–COOH (g)
- Cr2O72− (aq) + 8 H+ (aq) + 3 CH3–CH2–OH (g) → 2 Cr3+ (aq) + 7 H2O (l) + 3 CH3–CHO (g)
- CrO42− (aq) + 2 H+ (aq) + 3 CH3–CH2–OH (g) → Cr3+ (aq) + 4 H2O (l) + 3 CH3–CHO (g)
- Cr2O72− (aq) + 8 H+ (aq) + 3 CH3–CHO (g) → 2 Cr3+ (aq) + 4 H2O (l) + 3 CH3–COOH (g)
- CrO42− (aq) + 2 H+ (aq) + 3 CH3–CHO (g) → Cr2+ (aq) + H2O (l) + 3 CH3–COOH (g)
61. (Enem PPL 2020) O carvão é um combustível que tem várias substâncias em sua composição. Em razão disso, quando é representada sua queima com o oxigênio (massa molar 16 g mol−1), simplifica-se elaborando apenas a combustão completa do carbono (massa molar 12 g mol−1). De acordo com o conteúdo médio de carbono fixo, o carvão é classificado em vários tipos, com destaque para o antracito, que apresenta, em média, 90% de carbono. Esse elevado conteúdo favorece energeticamente a combustão, no entanto, libera maior quantidade de gás que provoca efeito estufa.
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
- 90,0.
- 210,0.
- 233,3.
- 330,0.
- 366,7.
62. (Enem 2015) Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco, que pode ser obtido a partir de um minério denominado esfalerita (ZnS), de pureza 75%. Considere que a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
ZnO + CO → Zn + CO2
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol); ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol)
Que valor mais próximo de massa de zinco metálico, em quilogramas, será produzido a partir de 100 kg de esfalerita?
- 25
- 33
- 40
- 50
- 54
63. (Enem 2014) A farinha de linhaça dourada é um produto natural que oferece grandes benefícios para o nosso organismo. A maior parte dos nutrientes da linhaça encontra-se no óleo desta semente, rico em substâncias lipossolúveis com massas moleculares elevadas. A farinha também apresenta altos teores de fibras proteicas insolúveis em água, celulose, vitaminas lipossolúveis e sais minerais hidrossolúveis.
Considere o esquema, que resume um processo de separação dos componentes principais da farinha de linhaça dourada

O óleo de linhaça será obtido na fração
- Destilado 1.
- Destilado 2.
- Resíduo 2.
- Resíduo 3.
- Resíduo 4.
64. (Enem 2013) Um princípio importante na produção de aço é a oxidação do excesso de carbono no ferro-gusa. O produto é chamado de ferro-gusa e contém cerca de 3,3% de carbono. Uma forma de eliminar o excesso de carbono é a oxidação a partir do aquecimento do ferro-gusa com gás oxigênio puro. Os dois principais produtos formados são aço doce (liga de ferro com teor de 0,3% de carbono restante) e gás carbônico. As massas molares aproximadas dos elementos carbono e oxigênio são, respectivamente, 12 g/mol e 16 g/mol.
LEE, J. D. Química Inorgânica não tão concisa. São Paulo: Edgard Blucher, 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
- 28.
- 75.
- 175.
- 275.
- 303.
65. (Enem PPL 2015) O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2 S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique "livre" e o enxofre se combine com o O2 produzindo SO2, conforme a equação química:
Cu2 S (s) + O2 (g) →Δ 2 Cu (l) + SO2 (g)
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em uma reação cujo rendimento é de 80%, a massa, em gramas, do minério necessária para obtenção do cobre é igual a
- 955.
- 1 018.
- 1 590.
- 2 035.
- 3 180.
66. (Enem PPL 2015) O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão d seu núcleo e libera uma grande quantidade de energia (2,35x1010 kJ/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima do carvão é representada pela equação química:
C(s) + O2(g) -> CO2(g) ΔH = -400 kJ mol
Qual é a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
- 2,10
- 7,70
- 9,00
- 33,0
- 300
67. (Enem PPL 2010) O flúor é usado de forma ampla na prevenção de cáries. Por reagir com a hidroxiapatita [Ca10(PO4)6(OH)2] presente nos esmaltes dos dentes, o flúor forma a fluorapatita [Ca10(PO4)6F2], um mineral mais resistente ao ataque ácido decorrente da ação de bactérias específicas presentes nos açúcares das placas que aderem aos dentes.
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
A reação de dissolução da hidroxiapatita é:

Supondo-se que o esmalte dentário seja constituído exclusivamente por hidroxiapatita, o ataque ácido que dissolve completamente 1 mg desse material ocasiona a formação de, aproximadamente,
- 0,14 mg de íons totais.
- 0,40 mg de íons totais.
- 0,58 mg de íons totais.
- 0,97 mg de íons totais.
- 1,01 mg de íons totais.
68. (Enem PPL 2010) Fator de emissão (carbon footprint) é um termo utilizado para expressar a quantidade de gases que contribuem para o aquecimento global, emitidos por uma fonte ou processo industrial específico. Pode-se pensar na quantidade de gases emitidos por uma indústria, uma cidade ou mesmo por uma pessoa. Para o gás CO2, a relação pode ser escrita:
Fator de emissão de CO2 = massa de CO2 emitida / quantidade de material
O termo "quantidade de material" pode ser, por exemplo, a massa de material produzido em uma indústria ou a quantidade de gasolina consumida por um carro em um determinado período.
No caso da produção do cimento, o primeiro passo é a obtenção do óxido de cálcio, a partir do aquecimento do calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos inorgânicos são adicionados ao óxido de cálcio, tendo o cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO2 = 44; CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 nº 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto, qual é, aproximadamente, o fator de emissão de CO2 quando 1 tonelada de cimento for produzida, levando-se em consideração apenas a etapa de obtenção do óxido de cálcio?
- 4,9 × 10-4
- 7,9 × 10-4
- 3,8 × 10-1
- 4,9 × 10-1
- 7,9 × 10-1
69. (Enem 2012) No Japão, um movimento nacional para a promoção da luta contra o aquecimento global leva o slogan: 1 pessoa, 1 dia, 1 kg de CO2 a menos! A ideia é cada pessoa reduzir em 1 kg a quantidade de CO2 emitida todo dia, por meio de pequenos gestos ecológicos, como diminuir a queima de gás de cozinha.
Um hamburguer ecológico? É pra já! Disponível em: http://lqes.iqm.unicamp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando um processo de combustão completa de um gás de cozinha composto exclusivamente por butano (C4H10), a mínima quantidade desse gás que um japonês deve deixar de queimar para atender à meta diária, apenas com esse gesto, é de
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
- 0,25 kg.
- 0,33 kg.
- 1,0 kg.
- 1,3 kg.
- 3,0 kg.
70. (Enem 2011) O peróxido de hidrogênio é comumente utilizado como antisséptico e alvejante. Também pode ser empregado em trabalhos de restauração de quadros enegrecidos e no clareamento de dentes. Na presença de soluções ácidas de oxidantes, como o permanganato de potássio, este óxido decompõe-se, conforme a equação a seguir:

De acordo com a estequiometria da reação descrita, a quantidade de permanganato de potássio necessária para reagir completamente com 20,0 mL de uma solução 0,1 mol/L de peróxido de hidrogênio é igual a
- 2,0×100 mol.
- 2,0×10-3 mol.
- 8,0×10-1 mol.
- 8,0×10-4 mol.
- 5,0×10-3 mol.
71. (Enem 2010) A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre (II) (CuSO4) durante 3 h, empregando-se uma corrente elétrica de intensidade igual a 10 A. A massa de cobre puro recuperada é de aproximadamente
Dados: Constante de Faraday F = 96 500 C/mol; Massa molar em g/mol: Cu = 63,5.
- 0,02 g.
- 0,04 g.
- 2,40 g.
- 35,5 g.
- 71,0 g.
72. (Enem 2009) O álcool hidratado utilizado como combustível veicular é obtido por meio da destilação fracionada de soluções aquosas geradas a partir da fermentação de biomassa. Durante a destilação, o teor de etanol da mistura é aumentado, até o limite de 96% em massa.
Considere que, em uma usina de produção de etanol, 800 kg de uma mistura etanol/água com concentração 20% em massa de etanol foram destilados, sendo obtidos 100 kg de álcool hidratado 96% em massa de etanol. A partir desses dados, é correto concluir que a destilação em questão gerou um resíduo com uma concentração de etanol em massa
- de 0%.
- de 8,0%.
- entre 8,4% e 8,6%.
- entre 9,0% e 9,2%.
- entre 13% e 14%.
73. (Enem 2011) Certas ligas estanho-chumbo com composição específica formam um eutético simples, o que significa que uma liga com essas características se comporta como uma substância pura, com um ponto de fusão definido, no caso 183 ºC. Essa é uma temperatura inferior mesmo ao ponto de fusão dos metais que compõem esta liga (o estanho puro funde a 232 ºC e o chumbo puro a 320 ºC), o que justifica sua ampla utilização na soldagem de componentes eletrônicos, em que o excesso de aquecimento deve sempre ser evitado. De acordo com as normas internacionais, os valores mínimo e máximo das densidades para essas ligas são de 8,74 g/mL e 8,82 g/mL, respectivamente. As densidades do estanho e do chumbo são 7,3 g/mL e 11,3 g/mL, respectivamente.
Um lote contendo 5 amostras de solda estanho-chumbo foi analisado por um técnico, por meio da determinação de sua composição percentual em massa, cujos resultados estão mostrados no quadro a seguir.

Com base no texto e na análise realizada pelo técnico, as amostras que atendem às normas internacionais são
- I e II.
- I e III.
- II e IV.
- III e V.
- IV e V.
74. (Enem PPL 2022) Um dos materiais mais antigos e ainda utilizados na restauração dos dentes são as amálgamas, um produto da combinação de mercúrio (Hg) com prata (Ag) e estanho (Sn), como apresenta a equação química:
24 Ag (s) + 8 Sn (s) + 37 Hg (l) → 12 Ag2 Hg3 (s) + Sn8 Hg (s)
Os materiais formados pelos elementos citados são caracterizados como
- precipitados.
- ligas metálicas.
- compostos iônicos.
- produtos de oxidação.
- compostos covalentes.
75. (Enem PPL 2022) Os airbags de segurança dos automóveis são acionados com o impacto, que envia um sinal elétrico para o dispositivo e inicia a reação explosiva do trinitreto de sódio (NaN3), produzindo sódio metálico e nitrogênio molecular, conforme a equação:
2 NaN3 (s) → 2 Na (s) + 3 N2 (g)
O gás produzido tem função de inflar o airbag. Esse tipo de dispositivo contém, aproximadamente, 100 g de NaN3.
Considere: PV = nRT; P = 1 atm; T = 25 °C;
R = 0,0821 L · atm/K · mol; 0 °C = 273 K
Massas molares: NaN3 = 65 g/mol; N2 = 28 g/mol; Na 23 g/mol
Nesse dispositivo, o volume de gás produzido, em litro, é
- 4,7.
- 9,4.
- 18,8.
- 56,5.
- 113,0.




