Equilíbrio
Lista de 51 exercícios deQuímicacom gabarito sobre o tema Equilíbrio com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o temaEquilíbrio.
01. (Enem PPL 2016) As águas dos oceanos apresentam uma alta concentração de íons e pH entre 8,0 e 8,3. Dentre esses íons estão em equilíbrio as espécies carbonato (CO32-) e bicarbonato (HCO3-), representado pela equação química:
HCO3- (aq) ⇄ CO32- (aq) + H+ (aq)
As águas dos rios, ao contrário, apresentam concentrações muito baixas de íons e substâncias básicas, com um pH em torno de 6. A alteração significativa do pH das águas dos rios e oceanos pode mudar suas composições químicas, por precipitação de espécies dissolvidas ou redissolução de espécies presentes nos sólidos suspensos ou nos sedimentos.
A composição dos oceanos é menos afetada pelo lançamento de efluentes ácidos, pois os oceanos
- contêm grande quantidade de cloreto de sódio.
- contêm um volume de água pura menor que o dos rios.
- possuem pH ácido, não sendo afetados pela adição de outros ácidos.
- têm a formação dos íons carbonato favorecida pela adição de ácido.
- apresentam um equilíbrio entre os íons carbonato e bicarbonato, que atuam como sistema-tampão.
02. (Enem PPL 1° Dia 2014) A tabela lista os valores de pH de algumas bebidas consumidas pela população.

O esmalte dos dentes é constituído de hidroxiapatita (Ca5(PO4)3OH), um mineral que sofre desmineralização em meio ácido, de acordo com a equação química:
Ca5(PO4)3OH (s) ⇄ 5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
Das bebidas listadas na tabela, aquela com menor potencial de desmineralização dos dentes é o
- chá.
- café.
- vinho.
- refrigerante.
- suco de limão.
03. (Enem PPL 2012) Com o aumento da demanda por alimentos e a abertura de novas fronteiras agrícolas no Brasil, faz-se cada vez mais necessária a correção da acidez e a fertilização do solo para determinados cultivos. No intuito de diminuir a acidez do solo de sua plantação (aumentar o pH), um fazendeiro foi a uma loja especializada para comprar conhecidos insumos agrícolas, indicados para essa correção. Ao chegar à loja, ele foi informado que esses produtos estavam em falta. Como só havia disponíveis alguns tipos de sais, o fazendeiro consultou um engenheiro agrônomo procurando saber qual comprar.
O engenheiro, após verificar as propriedades desses sais, indicou ao fazendeiro o
- KCl
- CaCO3
- NH4Cl
- Na2SO4
- Ba(NO3)2
04. (Enem PPL 2° Dia 2022) Considere que o leite materno, após sete meses do parto, é um alimento cujos principais constituintes são lipídeos. Uma mulher que está amamentando ingere, rotineiramente, alimentos contaminados com os pesticidas HCB, DDT, atrazina, paration e malation, cujas estruturas e dados de solubilidade em água estão apresentados no quadro.


O pesticida transmitido a um lactente (bebê em amamentação) de dez meses, em maior proporção, é o:
- Atrazina
- DDT
- HCB.
- Malation.
- Paration.
05. (Enem PPL 1° Dia 2010) O rótulo de uma garrafa de água mineral natural contém as seguintes informações:

As informações químicas presentes no rótulo de vários produtos permitem classificar o produto de várias formas, de acordo com seu gosto, seu cheiro, sua aparência, sua função, entre outras. As informações da tabela permitem concluir que essa água é
- gasosa.
- insípida.
- levemente azeda.
- um pouco alcalina.
- radioativa na fonte.
06. (Enem PPL 2023) Ácido nítrico é um importante reagente usado no preparo de nitrato de amônio, NH4NO3, um fertilizante nitrogenado. Industrialmente, o ácido nítrico é obtido a partir da reação da amônia com gás oxigênio, um processo que ocorre em três etapas, todas exotérmicas.
Etapa 1: 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (l)
Etapa 2: 2 NO (g) + O2 (g) → 2 NO2 (g)
Etapa 3: 3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g)
Na primeira etapa, forma-se NO, o qual reage com mais oxigênio formando NO2, um óxido ácido, que reage com a água formando HNO3 e NO. O composto NO é, portanto, um subproduto da reação. É importante o seu reaproveitamento, senão ele pode ser liberado para o ambiente, onde reagirá com o oxigênio, formando NO2.
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2006 (adaptado).
O procedimento que permite diminuir a quantidade formada do subproduto NO é aumentar a
- pressão de oxigênio, na etapa 1.
- concentração de NO2, na etapa 3.
- quantidade de amônia, na etapa 1.
- quantidade de oxigênio, na etapa 2.
- temperatura dos reagentes, na etapa 1.
07. (Enem Digital 2° Dia 2020) Reflorestamento é uma ação ambiental que visa repovoar áreas que tiveram a vegetação removida. Uma empresa deseja fazer um replantio de árvores e dispõe de cinco produtos que podem ser utilizados para corrigir o pH do solo que se encontra básico. As substâncias presentes nos produtos disponíveis são: CH3COONa, NH4Cl, NaBr, NaOH e KCl.
A substância a ser adicionada ao solo para neutralizá-lo é
- CH3COONa.
- NH4Cl.
- NaBr.
- NaOH.
- KCl.
08. (Enem PPL 2° dia 2019) O processo de calagem consiste na diminuição da acidez do solo usando compostos inorgânicos, sendo o mais usado o calcário dolomítico, que é constituído de carbonato de cálcio (CaCO3) e carbonato de magnésio (MgCO3). Além de aumentarem o pH do solo, esses compostos são fontes de cálcio e magnésio, nutrientes importantes para os vegetais.
Os compostos contidos no calcário dolomítico elevam o pH do solo, pois
- são óxidos inorgânicos.
- são fontes de oxigênio.
- o ânion reage com a água.
- são substâncias anfóteras.
- os cátions reagem com a água.
09. (Enem PPL 2° Dia 2018) O sulfato de bário (BaSO4) é mundialmente utilizado na forma de suspensão como contraste em radiografias de esôfago, estômago e intestino. Por se tratar de um sal pouco solúvel, quando em meio aquoso estabelece o seguinte equilíbrio:
BaSO4 (s) ⇄ Ba2+ (aq) + SO42- (aq)
Por causa da toxicidade do bário (Ba2+), é desejado que o contraste não seja absorvido, sendo totalmente eliminado nas fezes. A eventual absorção de íons Ba2+, porém, pode levar a reações adversas ainda nas primeiras horas após sua administração, como vômito, cólicas, diarreia, tremores, crises convulsivas e até mesmo a morte.
PEREIRA, L. F. Entenda o caso da intoxicação por Celobarf. Disponível em: www.unifesp.br. Acesso em: 20 nov. 2013 (adaptado).
Para garantir a segurança do paciente que fizer uso do contraste, deve-se preparar essa suspensão em
- água destilada.
- soro fisiológico.
- solução de cloreto de bário, BaCl2.
- solução de sulfato de bário, BaSO4.
- solução de sulfato de potássio, K2SO4.
10. (Enem PPL 2° Dia 2018) O aproveitamento integral e racional das matérias-primas lignocelulósicas poderá revolucionar uma série de segmentos industriais, tais como o de combustíveis, mediante a produção de bioetanol de segunda geração. Este processo requer um tratamento prévio da biomassa, destacando-se o uso de ácidos minerais diluídos. No pré-tratamento de material lignocelulósico por via ácida, empregou-se uma solução de ácido sulfúrico, que foi preparada diluindo-se 2 000 vezes uma solução de ácido sulfúrico, de concentração igual a 98 g/L, ocorrendo dissociação total do ácido na solução diluída. O quadro apresenta os valores aproximados de logaritmos decimais.

Sabendo-se que as massas molares, em g/mol, dos elementos H, O e S são, respectivamente, iguais a 1, 16 e 32, qual é o pH da solução diluída de ácido sulfúrico preparada conforme descrito?
- 2,6
- 3,0
- 3,2
- 3,3
- 3,6
11. (Enem PPL 1° Dia 2015) Cinco indústrias de ramos diferentes foram instaladas ao longo do curso de um rio. O descarte dos efluentes dessas indústrias acarreta impacto na qualidade de suas águas. O pH foi determinado em diferentes pontos desse rio, a 25 °C, e os resultados são apresentados no quadro.

A indústria que descarta um efluente com características básicas é a
- primeira.
- segunda.
- terceira.
- quarta.
- quinta.
12. (Enem PPL 1° Dia 2014) Fertilizantes químicos mistos, denominados NPK, são utilizados para aumentar a produtividade agrícola, por fornecerem os nutrientes nitrogênio, fósforo e potássio, necessários para o desenvolvimento das plantas. A quantidade de cada nutriente varia de acordo com a finalidade do adubo. Um determinado adubo NPK possui, em sua composição, as seguintes substâncias: nitrato de amônio (NH4NO3), ureia (CO(NH2)2), nitrato de potássio (KNO3), fosfato de sódio (Na3PO4) e cloreto de potássio (KCl).
A adição do adubo descrito provocou diminuição no pH de um solo. Considerando o caráter ácido/básico das substâncias constituintes desse adubo, a diminuição do pH do solo deve ser atribuída à presença, no adubo, de uma quantidade significativa de
- ureia.
- fosfato de sódio.
- nitrato de amônio.
- nitrato de potássio.
- cloreto de potássio.
13. (Enem PPL 2014) A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de água rica em CO2 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e HCO3-. Numa segunda etapa, a solução aquosa desses íons chega a uma caverna e ocorre a reação inversa, promovendo a liberação de CO2 e a deposição de CaCO3 de acordo com a equação apresentada.

Considerando o equilíbrio que ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a)
- diminuição da concentração de íons OH- no meio.
- aumento da pressão do ar no interior da caverna.
- diminuição da concentração de HCO3- no meio.
- aumento da temperatura no interior da caverna.
- aumento da concentração de CO2 dissolvido.
14. (Enem PPL 1° Dia 2010) O pH do solo pode variar em uma faixa significativa devido a várias causas. Por exemplo, o solo de áreas com chuvas escassas, mas com concentrações elevadas do sal solúvel carbonato de sódio (Na2CO3), torna-se básico devido à reação de hidrólise do íon carbonato, segundo o equilíbrio:

Esses tipos de solos são alcalinos demais para fins agrícolas e devem ser remediados pela utilização de aditivos químicos.
BAIRD, C. Química ambiental. São Paulo: Artmed, 1995 (adaptado).
Suponha que, para remediar uma amostra desse tipo de solo, um técnico tenha utilizado como aditivo a cal virgem (CaO). Nesse caso, a remediação
- foi realizada, pois o caráter básico da cal virgem promove o deslocamento do equilíbrio descrito para a direita, em decorrência da elevação de pH do meio.
- foi realizada, pois o caráter ácido da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da redução de pH do meio.
- não foi realizada, pois o caráter ácido da cal virgem promove o deslocamento do equilíbrio descrito para a direita, em decorrência da redução de pH do meio.
- não foi realizada, pois o caráter básico da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da elevação de pH do meio.
- não foi realizada, pois o caráter neutro da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da manutenção de pH do meio.
15. (Enem 2020) Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
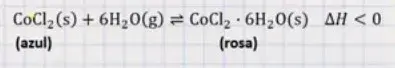
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
- Resfriaria no congelador.
- Borrifaria com spray de água.
- Envolveria com papel alumínio.
- Aqueceria com secador de cabelos.
- Embrulharia em guardanapo de papel.
16. (Enem PPL 2016) Utensílios de uso cotidiano e ferramentas que contêm ferro em sua liga metálica tendem a sofrer processo corrosivo e enferrujar. A corrosão é um processo eletroquímico e, no caso do ferro, ocorre a precipitação do óxido de ferro(III) hidratado, substância marrom pouco solúvel, conhecida como ferrugem. Esse processo corrosivo é, de maneira geral, representado pela equação química:

Uma forma de impedir o processo corrosivo nesses utensílios é
- renovar sua superfície, polindo-a semanalmente.
- evitar o contato do utensílio com o calor, isolando-o termicamente.
- impermeabilizar a superfície, isolando-a de seu contato com o ar úmido.
- esterilizar frequentemente os utensílios, impedindo a proliferação de bactérias.
- guardar os utensílios em embalagens, isolando-os do contato com outros objetos.
17. (Enem 2013) A formação frequente de grandes volumes de pirita (FeS2) em uma variedade de depósitos minerais favorece a formação de soluções ácidas ferruginosas, conhecidas como "drenagem ácida de minas". Esse fenômeno tem sido bastante pesquisado pelos cientistas e representa uma grande preocupação entre os impactos da mineração no ambiente. Em contato com oxigênio, a 25 ºC, a pirita sofre reação, de acordo com a equação química:
4 FeS2 (s) + 15 O2 (g) + 2 H2O (l) → 2 Fe2(SO4)3 (aq) + 2 H2SO4(aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
- sulfeto de sódio.
- cloreto de amônio.
- dióxido de enxofre.
- dióxido de carbono.
- carbonato de cálcio.
18. (Enem 2012) Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases. Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.

Dentre os materiais listados, quais são apropriados para amenizar esse odor?
- Álcool ou sabão.
- Suco de limão ou álcool.
- Suco de limão ou vinagre.
- Suco de limão, leite ou sabão.
- Sabão ou carbonato de sódio/barrilha.
19. (Enem 2011) Os refrigerantes têm-se tornado cada vez mais o alvo de políticas públicas de saúde. Os de cola apresentam ácido fosfórico, substância prejudicial à fixação de cálcio, o mineral que é o principal componente da matriz dos dentes. A cárie é um processo dinâmico de desequilíbrio do processo de desmineralização dentária, perda de minerais em razão da acidez. Sabe-se que o principal componente do esmalte do dente é um sal denominado hidroxiapatita. O refrigerante, pela presença da sacarose, faz decrescer o pH do biofilme (placa bacteriana), provocando a desmineralização do esmalte dentário. Os mecanismos de defesa salivar levam de 20 a 30 minutos para normalizar o nível do pH, remineralizando o dente. A equação química seguinte representa esse processo:

Considerando que uma pessoa consuma refrigerantes diariamente, poderá ocorrer um processo de desmineralização dentária, devido ao aumento da concentração de
- OH-, que reage com os íons Ca2+, deslocando o equilíbrio para a direita.
- H+, que reage com as hidroxilas OH-, deslocando o equilíbrio para a direita.
- OH-, que reage com os íons Ca2+, deslocando o equilíbrio para a esquerda.
- H+, que reage com as hidroxilas OH-, deslocando o equilíbrio para a esquerda.
- Ca2+, que reagem com as hidroxilas OH-, deslocando o equilíbrio para a esquerda.
20. (Enem 1° Dia 2010) O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente. Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço: as células a combustível hidrogênio/oxigênio.

Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/oxigênio diferencia-se dos processos convencionais porque
- transforma energia química em energia elétrica, sem causar danos ao meio ambiente, porque o principal subproduto formado é a água.
- converte a energia química contida nas moléculas dos componentes em energia térmica, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
- transforma energia química em energia elétrica, porém emite gases poluentes da mesma forma que a produção de energia a partir dos combustíveis fósseis.
- converte energia elétrica proveniente dos combustíveis fósseis em energia química, retendo os gases poluentes produzidos no processo sem alterar a qualidade do meio ambiente.
- converte a energia potencial acumulada nas moléculas de água contidas no sistema em energia química, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
21. (Enem 2025) Para a produção de titânio metálico ou dióxido de titânio puros, é necessário fazer a cloração do minério que contém dióxido de titânio, com o objetivo de separar esse óxido de outras substâncias presentes no minério. A principal reação química de cloração é representada por:
TiO2 (s) + 2 Cl2 (g) ⇄ TiCl4 (g) + O2 (g) ΔH = +175 kJ/mol
Depois da cloração, o tetracloreto de titânio é condensado e convertido, novamente, a dióxido de titânio.
Após o sistema atingir o equilíbrio químico, como a formação do TiCl4 pode ser favorecida?
- Aumentando a pressão total do sistema.
- Diminuindo a temperatura do sistema.
- Aumentando a pressão parcial de O2.
- Aumentando a pressão parcial de Cl2.
- Variando a quantidade de TiO2.
22. (Enem 2023) O vidro contendo alumínio em sua composição é um excelente material para acondicionar medicamentos e suplementos, porque pode ser esterilizado por aquecimento. No entanto, quando o medicamento ou suplemento contém substâncias que se ligam fortemente ao íon desse metal, a dissolução do alumínio é promovida em função do deslocamento do equilíbrio químico estabelecido entre a espécie imobilizada no vidro e a espécie em solução. Por essa razão, recomenda-se que suplementos de nutrição de recém-nascidos contendo gluconato de cálcio sejam acondicionados em embalagens plásticas, e não nesse tipo de vidro.
Atualização da recomendação da Sociedade Portuguesa de Neonatologia. Disponível em: www.spneonatologia.pt. Acesso em: 22 out. 2021 (adaptado).
Caso esse suplemento seja acondicionado em embalagem desse tipo de vidro, o risco de contaminação por alumínio será maior se o(a)
- vidro da frasco for translúcido.
- concentração de gluconato de cálcio for alta.
- frasco de vidro apresentar uma maior espessura.
- vidro for previamente esterilizado em altas temperaturas.
- reação do alumínio com gluconato de cálcio for endotérmica.
23. (Enem 2020) O dióxido de carbono passa para o estado sólido (gelo seco) a -78 °C e retorna ao estado gasoso à temperatura ambiente. O gás é facilmente solubilizado em água, capaz de absorver radiação infravermelha da superfície da terra e não conduz eletricidade. Ele é utilizado como matéria-prima para a fotossíntese até o limite de saturação. Após a fixação pelos organismos autotróficos, o gás retoma ao meio ambiente pela respiração aeróbica, fermentação, decomposição ou por resíduos industriais, queima de combustíveis fósseis e queimadas. Apesar da sua importância ecológica, seu excesso causa perturbações no equilíbrio ambiental.
Considerando as propriedades descritas, o aumento atmosférico da substância afetará os organismos aquáticos em razão da
- redução do potencial hidrogeniônico da água.
- restrição da aerobiose pelo excesso de poluentes.
- diminuição da emissão de oxigênio pelos autótrofos.
- limitação de transferência de energia entre os seres vivos.
- retração dos oceanos pelo congelamento do gás nos polos.
24. (Enem 2° Dia (Amarela) 2018) Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
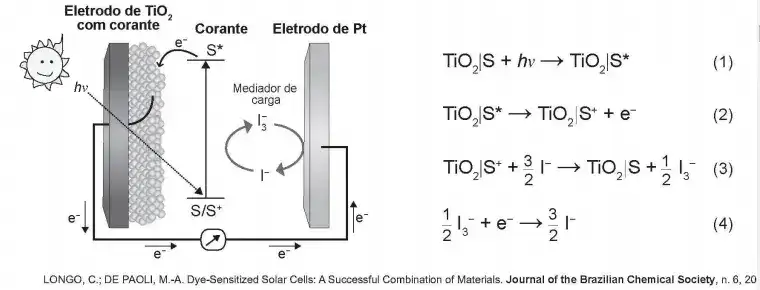
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
- reduz íons I– a I3–.
- regenera o corante.
- garante que a reação 4 ocorra.
- promove a oxidação do corante.
- transfere elétrons para o eletrodo de TiO2.
25. (Enem 2016) Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.

Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
- fenol.
- piridina.
- metilamina.
- hidrogenofosfato de potássio.
- hidrogenosulfato de potássio.
26. (Enem 2025) Para a produção de titânio metálico ou dióxido de titânio puros, é necessário fazer a cloração do minério que contém dióxido de titânio, com o objetivo de separar esse óxido de outras substâncias presentes no minério. A principal reação química de cloração é representada por:
TiO2 (s) + 2 Cl2 (g) ⇄ TiCl4 (g) + O2 (g) ΔH = +175 kJ/mol
Depois da cloração, o tetracloreto de titânio é condensado e convertido, novamente, a dióxido de titânio.
Após o sistema atingir o equilíbrio químico, como a formação do TiCl4 pode ser favorecida?
- Aumentando a pressão total do sistema.
- Diminuindo a temperatura do sistema.
- Aumentando a pressão parcial de O2.
- Aumentando a pressão parcial de Cl2.
- Variando a quantidade de TiO2.
27. (Enem 2023) O vidro contendo alumínio em sua composição é um excelente material para acondicionar medicamentos e suplementos, porque pode ser esterilizado por aquecimento. No entanto, quando o medicamento ou suplemento contém substâncias que se ligam fortemente ao íon desse metal, a dissolução do alumínio é promovida em função do deslocamento do equilíbrio químico estabelecido entre a espécie imobilizada no vidro e a espécie em solução. Por essa razão, recomenda-se que suplementos de nutrição de recém-nascidos contendo gluconato de cálcio sejam acondicionados em embalagens plásticas, e não nesse tipo de vidro.
Atualização da recomendação da Sociedade Portuguesa de Neonatologia. Disponível em: www.spneonatologia.pt. Acesso em: 22 out. 2021 (adaptado).
Caso esse suplemento seja acondicionado em embalagem desse tipo de vidro, o risco de contaminação por alumínio será maior se o(a)
- vidro da frasco for translúcido.
- concentração de gluconato de cálcio for alta.
- frasco de vidro apresentar uma maior espessura.
- vidro for previamente esterilizado em altas temperaturas.
- reação do alumínio com gluconato de cálcio for endotérmica.
28. (Enem 2020) O dióxido de carbono passa para o estado sólido (gelo seco) a -78 °C e retorna ao estado gasoso à temperatura ambiente. O gás é facilmente solubilizado em água, capaz de absorver radiação infravermelha da superfície da terra e não conduz eletricidade. Ele é utilizado como matéria-prima para a fotossíntese até o limite de saturação. Após a fixação pelos organismos autotróficos, o gás retoma ao meio ambiente pela respiração aeróbica, fermentação, decomposição ou por resíduos industriais, queima de combustíveis fósseis e queimadas. Apesar da sua importância ecológica, seu excesso causa perturbações no equilíbrio ambiental.
Considerando as propriedades descritas, o aumento atmosférico da substância afetará os organismos aquáticos em razão da
- redução do potencial hidrogeniônico da água.
- restrição da aerobiose pelo excesso de poluentes.
- diminuição da emissão de oxigênio pelos autótrofos.
- limitação de transferência de energia entre os seres vivos.
- retração dos oceanos pelo congelamento do gás nos polos.
29. (Enem 2° Dia (Amarela) 2018) Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.

A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
- reduz íons I– a I3–.
- regenera o corante.
- garante que a reação 4 ocorra.
- promove a oxidação do corante.
- transfere elétrons para o eletrodo de TiO2.
30. (Enem 2016) Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.

Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
- fenol.
- piridina.
- metilamina.
- hidrogenofosfato de potássio.
- hidrogenosulfato de potássio.
31. (Enem 1° Dia (Amarela) 2015) Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d'água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3(s) + CO2(g) + H2O (l) ⇌ Ca2+(aq) + 2 HCO3-(aq)
(II) HCO3-(aq) ⇌ H+(aq) + CO32-(aq) K1 = 3,0×10-11
(III) CaCO3(s) ⇌ Ca2+(aq) + CO32-(aq) K2 = 6,0×10-9
(IV) CO2(g) + H2O(l) ⇌ H+(aq) + HCO3-(aq) K3 = 2,5×10-7
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 °C, qual é o valor numérico da constante de equilíbrio da reação I?
- 4,5×10-26
- 5,0×10-5
- 0,8×10-9
- 0,2×105
- 2,2×1026
32. (Enem PPL 2014) Água dura é aquela que contém concentrações relativamente altas de íons Ca2+ e Mg2+ dissolvidos. Apesar de esses íons não representarem risco para a saúde, eles podem tornar a água imprópria para alguns tipos de consumo doméstico ou industrial. Objetivando reduzir a concentração de íons Ca2+ e Mg2+ de uma amostra de água dura ao mínimo possível, um técnico em química testou os seguintes procedimentos no laboratório:
I – Decantação da amostra de água.
II – Filtração da amostra de água.
III – Aquecimento da amostra de água.
IV – Adição do solvente orgânico CCl4 à amostra de água.
V – Adição de CaO e Na2CO3 à amostra de água.
BROWN, T. L. et al. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005 (adaptado).
O método considerado viável para tratar a água dura e aumentar seu potencial de utilização é o(a)
- decantação, pois permite que esses íons se depositem no fundo do recipiente.
- filtração, pois assim os íons Ca2+ e Mg2+ são retidos no filtro e separados da água.
- aquecimento da amostra de água, para que esses íons sejam evaporados e separados.
- adição do solvente orgânico CCl4 à amostra, para solubilizar esses íons e separá-los da água.
- reação química com CaO e Na2CO3, para precipitar esses íons na forma de compostos insolúveis.
33. (Enem 2014) Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0×10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa: CH3COOH, Na2SO4, CH3OH, K2CO3 e NH4Cl.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
- CH3COOH
- Na2SO4
- CH3OH
- K2CO3
- NH4Cl
34. (Enem 2010) Decisão de asfaltamento da rodovia MG-010, acompanhada da introdução de espécies exóticas, e a prática de incêndios criminosos, ameaçam o sofisticado ecossistema do campo rupestre da reserva da Serra do Espinhaço. As plantas nativas desta região, altamente adaptadas a uma alta concentração de alumínio, que inibe o crescimento das raízes e dificulta a absorção de nutrientes e água, estão sendo substituídas por espécies invasoras que não teriam naturalmente adaptação para este ambiente, no entanto elas estão dominando as margens da rodovia, equivocadamente chamada de "estrada ecológica". Possivelmente a entrada de espécies de plantas exóticas neste ambiente foi provocada pelo uso, neste empreendimento, de um tipo de asfalto (cimento-solo), que possui uma mistura rica em cálcio, que causou modificações químicas aos solos adjacentes à rodovia MG-010.
Scientific American. Brasil. Ano 7, nº 79. 2008 (adaptado).
Essa afirmação baseia-se no uso do cimento-solo, mistura rica em cálcio que
- inibe a toxicidade do alumínio, elevando o pH dessas áreas.
- inibe a toxicidade do alumínio, reduzindo o pH dessas áreas.
- aumenta a toxicidade do alumínio, elevando o pH dessas áreas.
- aumenta a toxicidade do alumínio, reduzindo o pH dessas áreas.
- neutraliza a toxicidade do alumínio, reduzindo o pH dessas áreas.
35. (Enem PPL 2020) A agricultura de frutas cítricas requer que o valor do pH do solo esteja na faixa ideal entre 5,8 e 6,0. Em uma fazenda, o valor do pH do solo é 4,6. O agricultor resolveu testar três produtos de correção de pH em diferentes áreas da fazenda. O primeiro produto possui íons sulfato e amônio, o segundo produto possui íons carbonato e cálcio e o terceiro produto possui íons sulfato e sódio.
O íon que vai produzir o efeito desejado de correção no valor do pH é o
- cálcio, porque sua hidrólise produz H+, que aumenta a acidez.
- amônio, porque sua hidrólise produz H+, que aumenta a acidez.
- sódio, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
- sulfato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
- carbonato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
36. (Enem 2019) A Hydrangea macrophylla é uma planta com flor azul ou cor-de-rosa, dependendo do pH do solo no qual está plantada. Em solo ácido (ou seja, com pH < 7) a flor é azul, enquanto que em solo alcalino (ou seja, com pH > 7) a flor é rosa. Considere que a Hydrangea cor-de-rosa mais valorizada comercialmente numa determinada região seja aquela produzida em solo com pH inferior a 8. Sabe-se que pH = – log10x. em que x é a concentração de íon hidrogênio (H+).
Para produzir a Hydrangea cor-de-rosa de maior valor comercial, deve-se preparar o solo de modo que x assuma
- qualquer valor acima de 10-8.
- qualquer valor positivo inferior a 10-7.
- valores maiores que 7 e menores que 8.
- valores maiores que 70 e menores que 80.
- valores maiores que 10-8 e menores que 10-7.
37. (Enem 2015) Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d'água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3(s) + CO2(g) + H2O (l) ⇌ Ca2+(aq) + 2 HCO3-(aq)
(II) HCO3-(aq) ⇌ H+(aq) + CO32-(aq) K1 = 3,0×10-11
(III) CaCO3(s) ⇌ Ca2+(aq) + CO32-(aq) K2 = 6,0×10-9
(IV) CO2(g) + H2O(l) ⇌ H+(aq) + HCO3-(aq) K3 = 2,5×10-7
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 °C, qual é o valor numérico da constante de equilíbrio da reação I?
- 4,5×10-26
- 5,0×10-5
- 0,8×10-9
- 0,2×105
- 2,2×1026
38. (Enem 2013) Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfectada. As equações das reações químicas envolvidas são:
Cl2 (g) + 2 H2O (l) ⇌ HClO (aq) + H3O+ (aq) + Cl− (aq)
HClO (aq) + H2O (l) ⇌ H3O+ (aq) + ClO− (aq) pKa = − log Ka = 7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
- 0.
- 5.
- 7.
- 9.
- 14.
39. (Enem PPL 2010) Às vezes, ao abrir um refrigerante, percebe-se que uma parte do produto vaza rapidamente pela extremidade do recipiente. A explicação para esse fato está relacionada à perturbação do equilíbrio químico existente entre alguns dos ingredientes do produto, de acordo com a equação:

A alteração do equilíbrio anterior, relacionada ao vazamento do refrigerante nas condições descritas, tem como consequência a
- liberação de CO2 para o ambiente.
- elevação da temperatura do recipiente.
- elevação da pressão interna no recipiente.
- elevação da concentração de CO2 no líquido.
- formação de uma quantidade significativa de H2O.
40. (Enem PPL 2013) À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio (NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H2O), produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial, produzindo bicarbonato de sódio (NaHCO3):
CO2 + H2O → H2CO3
H2CO3 + NaOH → NaHCO3 + H20
ARROIO, A. et al. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
- A solução mudará de cor, de azul para verde, e, em seguida, de verde para amarelo. Com o acréscimo de ácido carbônico, o pH da solução irá reduzir até tornar-se neutro. Em seguida, um excesso de ácido carbônico tornará o pH da solução ácido.
- A solução somente terá sua cor alterada de azul para amarelo, pois será formado um excesso de ácido carbônico no recipiente, o que reduzirá bruscamente o pH da solução.
- A cor da solução não será alterada com o acréscimo de ácido carbônico. Isso porque o meio é inicialmente neutro e a presença de ácido carbônico não produzirá nenhuma mudança no pH da solução.
- A solução mudará de azul para verde e, em seguida, de verde para azul. Isso ocorrerá em função da neutralização de um meio inicialmente básico acompanhado de um aumento de pH na solução, à medida que ácido carbônico é adicionado ao meio.
- A cor da solução alterará de azul para amarelo e, em seguida, de amarelo para verde. Esse comportamento é justificado pelo fato de o ácido carbônico reduzir bruscamente o pH da solução e depois ser neutralizado pelo restante de NaOH presente no meio.
41. (Enem 2019) Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192 g mol-1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.

A acidez total expressa em ácido cítrico de uma amostra comercial de polpa de fruta foi determinada. No procedimento, adicionou-se água destilada a 2,2 g da amostra e, após a solubilização do ácido cítrico, o sólido remanescente foi filtrado. A solução obtida foi titulada com solução de hidróxido de sódio 0,01 mol L-1, em que se consumiram 24 mL da solução básica (titulante).
BRASIL. Ministério da Agricultura c do Abastecimento. Instrução normativa n. 1, de 7 de janeiro de 2000. Disponível em: www agricultura gov.br, Acesso em: 9 maio 2019 (adaptado).
Entre as listadas, a amostra analisada pode ser de qual polpa de fruta?
- Apenas caju.
- Apenas maracujá.
- Caju ou graviola.
- Acerola ou cupuaçu.
- Cupuaçu ou graviola.
42. (Enem 2018) O manejo adequado do solo possibilita a manutenção de sua fertilidade à medida que as trocas de nutrientes entre matéria orgânica, água, solo e o ar são mantidas para garantir a produção. Alguns espécies iônicas de alumínio são tóxicas, não só para a planta, mas para muitos organismos como as bactérias responsáveis pelas transformações no ciclo do nitrogênio. O alumínio danifica as membranas das células das raízes e restringe a expansão de suas paredes, com isso, a planta não cresce adequadamente. Para promover benefícios para a produção agrícola, é recomendada a remediação do solo utilizando calcário (CaCO3).
BRADY, N. C.; WEIL, R. R. Elementos da natureza e propriedades dos solos. Porto alegre: Bookman, 2013 (adaptado).
Essa remediação promove no solo o(a)
- diminuição do pH, deixando-o fértil.
- solubilização do alumínio, ocorrendo sua lixiviação pela chuva.
- interação do íon cálcio com o íon alumínio, produzindo uma liga metálica.
- reação do carbonato de cálcio com os íons alumínio, formando alumínio metálico.
- aumento da sua alcalinidade, tornando os íons alumínio menos disponíveis.
43. (Enem 2021) No cultivo por hidroponia, são utilizadas soluções nutritivas contendo macronutrientes e micronutrientes essenciais. Além dos nutrientes, o pH é um parâmetro de extrema importância, uma vez que ele afeta a preparação da solução nutritiva e a absorção dos nutrientes pelas plantas. Para o cultivo de alface, valores de pH entre 5,5 e 6,5 são ideais para o seu desenvolvimento. As correções de pH são feitas pela adição de compostos ácidos ou básicos, mas não devem introduzir elementos nocivos às plantas. Na tabela, são apresentados alguns dados da composição da solução nutritiva de referência para esse cultivo. Também é apresentada a composição de uma solução preparada por um produtor de cultivo hidropônico.

Para correção do pH da solução nutritiva preparada, esse produtor pode empregar uma solução de
- ácido fosfórico, H3PO4.
- sulfato de cálcio, CaSO4.
- óxido de alumínio, Al2O3.
- cloreto de ferro(II), FeCl2.
- hidróxido de potássio, KOH.
44. (Enem PPL 2021) Os compostos iônicos CaCO3 e NaCl têm solubilidades muito diferentes em água. Enquanto o carbonato de cálcio, principal constituinte do mármore, é praticamente insolúvel em água, o sal de cozinha é muito solúvel. A solubilidade de qualquer sal é o resultado do balanço entre a energia mde rede (energia necessária para separar completamente os íons do sólido cristalino) e a energia envolvida na hidratação dos íons dispersos em solução.
Em relação à energia de rede, a menor solubilidade do primeiro composto é explicada pelo fato de ele apresentar maior
- atração entre seus íons.
- densidade do sólido iônico.
- energia de ionização do cálcio.
- eletronegatividade dos átomos.
- polarizabilidade do íon carbonato.
45. (Enem PPL 2022) Solos ácidos apresentam baixo valor de pH, e o plantio de culturas nesse meio acarreta baixa produção agrícola. Entretanto, esse problema pode ser contornado adicionando-se substâncias que, ao entrarem em contato com a água, liberam íons OH−, que neutralizam os íons H3 O+ presentes no solo e elevam o seu pH. Para esse objetivo, um agricultor tem comercialmente à disposição as espécies químicas enumeradas:
I – KCl II – MgO III – NH4 Br IV – AlCl3 V – P2 O5
Para a correção do pH desse solo, o agricultor deverá utilizar a espécie química indicada pelo número
- I.
- II.
- III.
- IV.
- V.
46. (Enem 2024) A hidroxiapatita, Ca5(PO4)3OH, é um mineral constituinte do esmalte dos dentes. Entre as diversas reações que ocorrem no meio bucal, encontram-se em equilíbrio as reações de desmineralização e mineralização da hidroxiapatita em meio aquoso, ilustradas a seguir. A desmineralização está associada à fragilização do esmalte do dente e à formação de cáries.

O uso de creme dental pode minimizar a perda da hidroxiapatita. O quadro apresenta o agente de polimento e o pH de alguns cremes dentais comerciais.

STORGATTO, G.A.; BRAIBANTE, M. E. F.: BRAIBANTE, H. A química na odontologia. Química Nova na Escola, V. 39, fev. 2017 (adaptado).
Considerando o equilíbrio químico envolvido, qual creme dental promove a maior desmineralização do esmalte do dente?
- I
- II
- III
- IV
- V
47. (Enem PPL 2023) Um chefe de cozinha experimental dispõe, em seu laboratório, de cinco soluções aquosas, dentre as quais deve escolher uma para eliminar o odor de peixe, por meio da neutralização do grupo amino (R―NH2), em que R representa um grupo alquil. Suponha que a molécula responsável pelo odor é a metilamina (CH3NH2, Kb = 5,5 × 10−4). O quadro apresenta dados de acidez/basicidade de algumas espécies químicas.

Qual substância deve ser escolhida pelo chefe de cozinha?
- NaClO
- NaHCO3
- CH3COOH
- NaCl
- CH3CH2OH
48. (Enem PPL 2023) Os agentes lacrimogêneos são espécies químicas capazes de provocar forte irritação das vias aéreas superiores e dos olhos. Até o final da década de 1960, a cloroacetofenona (CA) foi a substância mais utilizada com essa finalidade. Uma forma de descontaminar a pele exposta à CA consiste em lavá-la com uma solução aquosa de determinado sal, o qual reagirá com a CA, conforme a reação representada

Qual destes compostos pode ser usado para fazer essa descontaminação?
- NaCH3COO
- NaHCO3
- NaHSO3
- Na2SO4
- NaOH
49. (Enem PPL 2017) Alguns profissionais burlam a fiscalização quando adicionam quantidades controladas de solução aquosa de hidróxido de sódio a tambores de leite de validade vencida. Assim que o teor de acidez, em termos de ácido lático, encontra-se na faixa permitida pela legislação, o leite adulterado passa a ser comercializado. A reação entre o hidróxido de sódio e o ácido lático pode ser representada pela equação química:
CH3CH(OH)COOH (aq) + NaOH (aq) → CH3CH(OH)COONa (aq) + H2O (l)
A consequência dessa adulteração e o(a)
- aumento do pH do leite.
- diluição significativa do leite.
- precipitação do lactato de sódio.
- diminuição da concentração de sais.
- aumento da concentração dos íons H+.
50. (Enem 2016 - 3.ª Aplicação) As águas dos oceanos apresentam uma alta concentração de íons e pH entre 8,0 e 8,3. Dentre esse íons estão em equilíbrio as espécies carbonato (CO32-) e bicarbonato (HCO3-), representado pela equação química:
HCO3- (aq) ⇌ CO32- (aq) + H+ (aq)
As águas dos rios, ao contrário, apresentam concentrações muito baixas de íons e substâncias básicas, com um pH em torno de 6. A alteração significativa do pH das águas dos rios e oceanos pode mudar suas composições químicas, por precipitação de espécies dissolvidas ou redissolução de espécies presentes nos sólidos suspensos ou nos sedimentos.
A composição dos oceanos é menos afetada pelo lançamento de efluentes ácidos, pois os oceanos
- contêm grande quantidade de cloretode sódio.
- contêm um volume de água pura menor que o dos rios.
- possuem pH ácido, não sendo afetados pela adiação de outros ácidos.
- têm a formação dos íons carbonato favorecida pela adição de ácido.
- apresentam um equilíbrio entre os íons carbonato e bicarbonato, que atuam como sistema-tampão.
51. (Enem 2016 - 3.ª Aplicação) A água consumida na maioria das cidades brasileiras é obtida pelo tratamento da água de mananciais. A parte inicial do tratamento consiste no peneiramento e sedimentação de partículas maiores. Na etapa seguinte, dissolvem-se na água carbonato de sódio e, em seguida, sulfato de alumínio. O resultado é a precipitação de hidróxido de alumínio, que é pouco solúvel em água, o qual leva consigo as partículas poluentes menores. Posteriormente, a água passa por um processo de desinfecção e, finalmente, é disponibilizada para o consumo.
No processo descrito, a precipitação de hidróxido de alumínio é viabilizada porque
- a dissolução do alumínio resfria a solução.
- o excesso de sódio impossibilita sua solubilização.
- a oxidação provocada pelo sulfato produz hidroxilas.
- as partículas contaminantes menores atraem essa substância.
- o equilíbrio químico do carbonato em água torna o meio alcalino.