Eletroquímica
Lista de 41 exercícios deQuímicacom gabarito sobre o tema Eletroquímica com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o temaEletroquímica.
01. (Enem 2012) O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma "lenda urbana", pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:

Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
- Somente o lítio, pois ele possui o menor potencial de redução.
- Somente o cobre, pois ele possui o maior potencial de redução.
- Somente o potássio, pois ele possui potencial de redução mais próximo do magnésio.
- Somente o cobre e o zinco, pois eles sofrem oxidação mais facilmente que o alumínio.
- Somente o lítio e o potássio, pois seus potenciais de redução são menores do que o do alumínio.
02. (Enem 2022) A figura ilustra esquematicamente um processo de remediação de solos contaminados com tricloroeteno (TCE), um agente desengraxante. Em razão de vazamentos de tanques de estocagem ou de manejo inapropriado de resíduos industriais, ele se encontra presente em águas subterrâneas, nas quais forma uma fase líquida densa não aquosa (DNAPL) que se deposita no fundo do aquifero. Essa tecnologia de descontaminação emprega o Íon persulfato (S2O82-), que é convertido no radical •SO4- por minerais que contêm Fe(III). O esquema representa de forma simplificada o mecanismo de ação química sobre o TCE e a formação dos produtos de degradação.

Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
- oxirredução.
- substituição.
- precipitação.
- desidratação.
- neutralização.
03. (Enem 2022) A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4 Fe (s) + 2 H2O (l) + 3 O2 (g) → 2 Fe2O3 · H2O (s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (Al2O3) sobre a superfície do objeto que se deseja proteger.
CLEMENTE, G.A. B. F. et al. O uso de materiais híbridos ou nanocompósitos como revestimentos anticorrosivos do aço. Química Nova, n. 9, 2021 (adaptado).
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a)
- proteção catódica, que utiliza um metal fortemente redutor.
- uso de metais de sacrifício, que se oxidam no lugar do ferro.
- passivação do ferro, que fica revestido pelo seu próprio óxido.
- efeito de barreira, que impede o contato com o agente oxidante.
- galvanização, que usa outros metais de menor potencial de redução.
04. (Enem 3ª Aplicação - 1° Dia 2016) Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg (s) + 2 H2O (l) → Mg(OH)2 (s) + H2 (g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da
- redução sofrida pelo oxigênio, que é uma reação exotérmica.
- oxidação sofrida pelo magnésio, que é uma reação exotérmica.
- redução sofrida pelo magnésio, que é uma reação endotérmica.
- oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
- redução sofrida pelo hidrogênio, que é uma reação endotérmica.
05. (Enem 2° Dia (Verde) 2025) Objetos de prata escurecem em contato com compostos contendo enxofre por causa da formação de uma fina camada de sulfeto de prata. Um método simples para clarear o objeto consiste em forrar um recipiente com papel alumínio, adicionar ao recipiente uma solução aquosa de cloreto de sódio e, enfim, mergulhar o objeto de prata enegrecido. Em cerca de três minutos, a prata volta à coloração original. As seguintes semirreações e os respectivos potenciais-padrão de redução são úteis para a compreensão dos fenômenos ocorridos.
Ag2S (s) + 2 e– → 2 Ag (s) + S2– (aq) –0,69 V
O2 (g) + 4 H+ (aq) + 4 e– → 2 H2O(l) +1,23 V
Al3+ (aq) + 3 e– → Al(s) –1,68 V
SARTORI, E. R.; BATISTA, E. F.; FATIBELLO-FILHO, O. Escurecimento e limpeza de objetos de prata: um experimento simples e de fácil execução envolvendo reações de oxidação-redução. Química Nova na Escola, n. 30, 2008 (adaptado).
Os valores das diferenças de potencial-padrão das reações que representam o escurecimento e o clareamento do objeto de prata são, respectivamente:
- +0,54 V e +2,37 V.
- +1,92 V e +0,99 V.
- –0,15 V e +5,43 V.
- +2,61 V e +1,29 V.
- +0,15 V e –1,29 V.
06. (Enem Digital 2° Dia 2020) As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas que atuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célula eletrolítica, quando estão sendo recarregadas. Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial padrão de redução dessas espécies:
Ni2+(aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço, a diferença de potencial mínima, em volt, que ele deve superar é de
- 0,086.
- 0,172.
- 0,316.
- 0,632.
- 1,264.
07. (Enem Digital 2° Dia 2020) Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
3 Ag2S (s) + 2 Al (s) + 8 NaOH (aq) → 6 Ag (s) + 3 Na2S (aq) + 2 NaAlO2(aq) + 4 H2O (l)
A restauração do objeto de prata ocorre por causa do(a)
- prata, que reduz o enxofre.
- íon sulfeto, que sofre oxidação.
- íon hidróxido, que atua como agente oxidante.
- alumínio, que atua como agente redutor no processo.
- variação do pH do meio reacional, que aumenta durante a reação.
08. (Enem 2018) Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
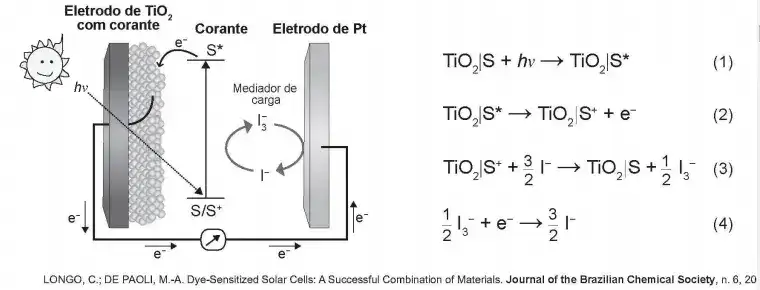
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
- reduz íons I– a I3–.
- regenera o corante.
- garante que a reação 4 ocorra.
- promove a oxidação do corante.
- transfere elétrons para o eletrodo de TiO2.
09. (Enem 2016) Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.

Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
- fenol.
- piridina.
- metilamina.
- hidrogenofosfato de potássio.
- hidrogenosulfato de potássio.
10. (Enem 2014) A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)23-. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.

Das espécies apresentadas, a adequada para essa recuperação é
- Cu (s).
- Pt (s).
- Al3+ (aq).
- Sn (s).
- Zn2+ (aq).
11. (Enem 2009) Para que apresente condutividade elétrica adequada a muitas aplicações, o cobre bruto obtido por métodos térmicos é purificado eletroliticamente. Nesse processo, o cobre bruto impuro constitui o ânodo da célula, que está imerso em uma solução de CuSO4. À medida que o cobre impuro é oxidado no ânodo, íons Cu2+ da solução são depositados na forma pura no cátodo. Quanto às impurezas metálicas, algumas são oxidadas, passando à solução, enquanto outras simplesmente se desprendem do ânodo e se sedimentam abaixo dele. As impurezas sedimentadas são posteriormente processadas, e sua comercialização gera receita que ajuda a cobrir os custos do processo. A série eletroquímica a seguir lista o cobre e alguns metais presentes como impurezas no cobre bruto de acordo com suas forças redutoras relativas.

Entre as impurezas metálicas que constam na série apresentada, as que se sedimentam abaixo do ânodo de cobre são
- Au, Pt, Ag, Zn, Ni e Pb.
- Au, Pt e Ag.
- Zn, Ni e Pb.
- Au e Zn.
- Ag e Pb.
12. (Enem 2013) A formação frequente de grandes volumes de pirita (FeS2) em uma variedade de depósitos minerais favorece a formação de soluções ácidas ferruginosas, conhecidas como "drenagem ácida de minas". Esse fenômeno tem sido bastante pesquisado pelos cientistas e representa uma grande preocupação entre os impactos da mineração no ambiente. Em contato com oxigênio, a 25 ºC, a pirita sofre reação, de acordo com a equação química:
4 FeS2 (s) + 15 O2 (g) + 2 H2O (l) → 2 Fe2(SO4)3 (aq) + 2 H2SO4(aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
- sulfeto de sódio.
- cloreto de amônio.
- dióxido de enxofre.
- dióxido de carbono.
- carbonato de cálcio.
13. (Enem 1° Dia 2010) As baterias de Ni-Cd muito utilizadas no nosso cotidiano não devem ser descartadas em lixos comuns uma vez que uma considerável quantidade de cádmio é volatilizada e emitida para o meio ambiente quando as baterias gastas são incineradas como componente do lixo. Com o objetivo de evitar a emissão de cádmio para a atmosfera durante a combustão é indicado que seja feita a reciclagem dos materiais dessas baterias. Uma maneira de separar o cádmio dos demais compostos presentes na bateria é realizar o processo de lixiviação ácida. Nela, tanto os metais (Cd, Ni e eventualmente Co) como os hidróxidos de íons metálicos Cd(OH)2(s), Ni(OH)2(s), Co(OH)2(s) presentes na bateria, reagem com uma mistura ácida e são solubilizados. Em função da baixa seletividade (todos os íons metálicos são solubilizados), após a digestão ácida, é realizada uma etapa de extração dos metais com solventes orgânicos de acordo com a reação. O gráfico mostra resultado da extração utilizando os solventes orgânicos X e Y em diferentes pH.
A reação descrita no texto mostra o processo de extração dos metais por meio da reação com moléculas orgânicas, X e Y. Considerando-se as estruturas de X e Y e o processo de separação descrito, pode-se afirmar que
- as moléculas X e Y atuam como extratores catiônicos uma vez que a parte polar da molécula troca o íon H+ pelo cátion do metal.
- as moléculas X e Y atuam como extratores aniônicos uma vez que a parte polar da molécula troca o íon H+ pelo cátion do metal.
- as moléculas X e Y atuam como extratores catiônicos uma vez que a parte polar da molécula troca o íon PO22- pelo cátion do metal.
- as moléculas X e Y atuam como extratores aniônicos uma vez que a parte polar da molécula troca o íon PO22- pelo cátion do metal.
- as moléculas X e Y fazem ligações com os íons metálicos resultando em compostos com caráter apolar o que justifica a eficácia da extração.
14. (Enem PPL 2022) A bula de um determinado medicamento traz as seguintes informações:

De acordo com as informações apresentadas na bula, a substância que se encontra em maior concentração e a não condutora de corrente elétrica, quando em solução aquosa, são, respectivamente,
- glicose e glicose.
- glicose e cloreto de sódio.
- cloreto de sódio e glicose.
- cloreto de potássio e glicose.
- cloreto de sódio e cloreto de potássio.
15. (Enem 1° Dia 2010) O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente. Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço: as células a combustível hidrogênio/oxigênio.

Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/oxigênio diferencia-se dos processos convencionais porque
- transforma energia química em energia elétrica, sem causar danos ao meio ambiente, porque o principal subproduto formado é a água.
- converte a energia química contida nas moléculas dos componentes em energia térmica, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
- transforma energia química em energia elétrica, porém emite gases poluentes da mesma forma que a produção de energia a partir dos combustíveis fósseis.
- converte energia elétrica proveniente dos combustíveis fósseis em energia química, retendo os gases poluentes produzidos no processo sem alterar a qualidade do meio ambiente.
- converte a energia potencial acumulada nas moléculas de água contidas no sistema em energia química, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
16. (Enem PPL 2020) Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.

Dos metais citados, o que garantirá proteção ao tanque de aço é o
- zinco.
- cobre.
- níquel.
- cádmio.
- mercúrio.
17. (Enem PPL 2020) Um cidadão que se mudou de Brasília para Recife, após algum tempo, percebeu que partes de seu carro estavam enferrujando muito rapidamente. Perguntou para seu filho, estudante do ensino médio, a explicação para o fenômeno. O filho pesquisou na internet e descobriu que, por causa da maresia, gotículas de água do mar atingem os objetos de aço (liga de ferro e carbono) e intensificam sua corrosão. Com base nessa informação, o estudante explicou corretamente ao pai o efeito do cloreto de sódio na corrosão.
A explicação correta de a maresia acelerar a corrosão do aço é porque
- reduz o ferro.
- oxida o carbono.
- dissolve a pintura do carro.
- torna a água mais condutora.
- diminui a dissolução do oxigênio na água.
18. (Enem 2019) Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (E0) da água e de outras espécies em meio básico, expresso no quadro.

Qual é a outra espécie que está presente na composição da mistura sólida comercial para aumentar sua eficiência?
- Al
- Co
- Cu(OH)2
- Fe(OH)2
- Pb
19. (Enem 2019) Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando à produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.

No funcionamento da bateria, a espécie química formada no anôdo é
- H2 (g).
- O2 (g).
- H2O (l).
- OH- (aq).
- Zn(OH)42- (aq).
20. (Enem 2018) Em 1938 o arqueólogo alemão Wilhelm König, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução: E θ(Fe2+|Fe) = –0,44 V; E θ(H+|H2) = 0,00 V; e E θ(Cu2+|Cu) = +0,34 V.

Nessa suposta pilha, qual dos componentes atuaria como cátodo?
- A tampa de betume.
- O vestígio de ácido.
- A barra de ferro.
- O tubo de cobre.
- O vaso de barro.
21. (Enem 2017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.

No processo eletrolítico ilustrado, o produto secundário obtido é o
- vapor de água.
- oxigênio molecular.
- hipoclorito de sódio.
- hidrogênio molecular.
- cloreto de hidrogênio.
22. (Enem 2017) A invenção do LED azui, que permite a geração de outras cores para compor a luz branca, permitido a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
23. (Enem 2013) Eu também podia decompor a água, se fosse salgada ou acidulada, usando a pilha de Daniell como fonte de força. Lembro o prazer extraordinário que sentia ao decompor um pouco de água em uma taça para ovos quentes, vendo-a separar-se em seus elementos, o oxigênio em um eletrodo, o hidrogênio no outro. A eletricidade de uma pilha de 1 volt parecia tão fraca, e no entanto podia ser suficiente para desfazer um composto químico, a água...
SACKS, O. Tio Tungstênio: memórias de uma infância química. São Paulo: Cia. das Letras, 2002.
O fragmento do romance de Oliver Sacks relata a separação dos elementos que compõem a água.
O princípio do método apresentado é utilizado industrialmente na
- obtenção de ouro a partir de pepitas.
- obtenção de calcário a partir de rochas.
- obtenção de alumínio a partir da bauxita.
- obtenção de ferro a partir de seus óxidos.
- obtenção de amônia a partir de hidrogênio e nitrogênio.
24. (Enem 2013) Músculos artificiais são dispositivos feitos com plásticos inteligentes que respondem a uma corrente elétrica com um movimento mecânico. A oxidação e redução de um polímero condutor criam cargas positivas e/ou negativas no material, que são compensadas com a inserção ou expulsão de cátions ou ânions. Por exemplo, na figura os filmes escuros são de polipirrol e o filme branco é de um eletrólito polimérico contendo um sal inorgânico. Quando o polipirrol sofre oxidação, há a inserção de ânions para compensar a carga positiva no polímero e o filme de expande. Na outra face do dispositivo o filme de polipirrol sofre redução, expulsando os ânions, e o filme se contrai. Pela montagem em sanduíche, o sistema todo se movimenta de forma harmônica, conforme mostrado na figura.

A camada central de eletrólito polimérico é importante porque
- absorve a irradiação de partículas carregadas, emitidas pelo aquecimento elétrico dos filmes de polipirrol.
- permite a difusão dos íons promovida pela aplicação de diferença de potencial, fechando o circuito elétrico.
- mantém um gradiente térmico no material para promover a dilatação/contração térmica de cada filme de polipirrol.
- permite a condução de elétrons livres, promovida pela aplicação de diferença de potencial, gerando corrente elétrica.
- promove a polarização das moléculas poliméricas, o que resulta no movimento gerado pela aplicação de diferença de potencial.
25. (Enem PPL 2013) Se dermos uma mordida em um pedaço de papel alumínio colocado em cima de uma obturação de amálgama (combinação do mercúrio metálico com metais e/ou ligas metálicas), sentiremos uma dor causada por uma corrente que pode chegar até 30 μA.
SILVA, R. R. et al. Química Nova na Escola, São Paulo, n. 13, maio 2001 (adaptado).
O contato dos materiais metálicos citados produz
- uma pilha, cujo fluxo de elétrons é espontâneo.
- uma eletrólise, cujo fluxo de elétrons não é espontâneo.
- uma solução eletrolítica, cujo fluxo de elétrons é espontâneo.
- um sistema galvânico, cujo fluxo de elétrons não é espontâneo.
- um sistema eletrolítico, cujo fluxo de elétrons não é espontâneo.
26. (Enem PPL 2011) Iniciativas do poder público para prevenir o uso de bebidas alcoólicas por motoristas, causa de muitos acidentes nas estradas do país, trouxeram à ordem do dia, não sem suscitar polêmica, o instrumento popularmente conhecido como bafômetro. Do ponto de vista de detecção e medição, os instrumentos normalmente usados pelas polícias rodoviárias do Brasil e de outros países utilizam o ar que os "suspeitos" sopram para dentro do aparelho, através de um tubo descartável, para promover a oxidação do etanol a etanal. O método baseia-se no princípio da pilha de combustível: o etanol é oxidado em meio ácido sobre um disco plástico poroso coberto com pó de platina (catalisador) e umedecido com ácido sulfúrico, sendo um eletrodo conectado a cada lado desse disco poroso. A corrente elétrica produzida, proporcional à concentração de álcool no ar expirado dos pulmões da pessoa testada, é lida numa escala que é proporcional ao teor de álcool no sangue. O esquema de funcionamento desse detector de etanol pode ser visto na figura.

No estudo das pilhas, empregam-se códigos e nomenclaturas próprias da Química, visando caracterizar os materiais, as reações e os processos envolvidos.
Nesse contexto, a pilha que compõe o bafômetro apresenta o
- eletrodo A como cátodo.
- etanol como agente oxidante.
- eletrodo B como polo positivo.
- gás oxigênio como agente redutor.
- fluxo de elétrons do eletrodo B para o eletrodo A.
27. (Enem PPL 2013) O Instituto Luiz Coimbra (UFRJ) lançou o primeiro ônibus urbano movido a hidrogênio do Hemisfério Sul, com tecnologia inteiramente nacional. Sua tração provém de três fontes de energia, sendo uma delas a pilha de combustível, na qual o hidrogênio, gerado por um processo eletroquímico, reage com o oxigênio do ar, formando água.
FRAGA, I. Disponível em: http://cienciahoje.uol.com.br. Acesso em: 20 jul. 2010 (adaptado).
A transformação de energia que ocorre na pilha de combustível responsável pelo movimento do ônibus decorre da energia cinética oriunda do(a)
- calor absorvido na produção de água.
- expansão gasosa causada pela produção de água.
- calor liberado pela reação entre o hidrogênio e o oxigênio.
- contração gasosa causada pela reação entre o hidrogênio e o oxigênio.
- eletricidade gerada pela reação de oxirredução do hidrogênio com o oxigênio.
28. (Enem 2010) A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre (II) (CuSO4) durante 3 h, empregando-se uma corrente elétrica de intensidade igual a 10 A. A massa de cobre puro recuperada é de aproximadamente
Dados: Constante de Faraday F = 96 500 C/mol; Massa molar em g/mol: Cu = 63,5.
- 0,02 g.
- 0,04 g.
- 2,40 g.
- 35,5 g.
- 71,0 g.
29. (Enem 2021) O emprego de células de combustível a hidrogênio pode ser uma tecnologia adequada ao transporte automotivo. O quadro apresenta características de cinco tecnologias mais proeminentes de células de combustível.

Testes operacionais com esses tipos de células têm indicado que as melhores alternativas para veículos são as que operam em baixos níveis de energia térmica, são formadas por membranas de eletrólitos poliméricos e ocorrem em meio ácido.
THOMAS, S; ZALBOWITZ, M. Full cells: green power. Los Alamos National Laboratory. Los Alamos, NM, 1999 (adaptado).
A tecnologia testada mais adequada para o emprego em veículos automotivos é a célula de combustível
- AFC.
- MSFC.
- PEM.
- PAFC.
- SOFC.
30. (Enem 2021) O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
L2 + 2 e- → 2l- E° = +0,54 V
Li+ + e- → Li E° = -3,05 V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
- I.
- II.
- III.
- IV.
- V.
31. (Enem 2021) O ciclo do cobre é um experimento didático em que o cobre metálico é utilizado como reagente de partida. Após uma sequência de reações (I, II, III, IV e V), o cobre retorna ao seu estado inicial ao final do ciclo.

A reação de redução do cobre ocorre na etapa
- I.
- II.
- III.
- IV.
- V.
32. (Enem PPL 2021) Um produto, obtido industrialmente da eletrólise de solução aquosa de cloreto de sódio, tem sido amplamente empregado na indústria, por exemplo, na fabricação de papéis, tecidos e sabões. Normalmente, esse produto é usado na desobstrução de encanamentos e sumidouros, pois é capaz de reagir com gorduras. No entanto, a sua manipulação exige cuidados, pois é altamente corrosivo, podendo, em contato com a pele, provocar vermelhidão, irritação ou "queimaduras" de tecidos vivos. Além disso, se o frasco do produto for abandonado aberto por um longo período de tempo, ele pode absorver CO2 convertendo-se em um sal.
Esse produto industrial é o
- cloro molecular, Cl2.
- ácido clorídrico, HCI.
- ácido sulfúrico, H2SO4.
- hidróxido de sódio, NaOH.
- carbonato de sódio, Na2CO3.
33. (Enem 2024) Placas solares comuns dependem de dias ensolarados para gerar energia. Mas podemos gerar eletricidade com a ajuda de gotas de chuva, revestindo placas solares com uma fina camada de grafeno. Os íons dissociados a partir da água da chuva (Am+ e Bn+) tornam a combinação grafeno e água da chuva um par perfeito para geração de energia. O processo requer apenas uma camada de grafeno para que grande quantidade de elétrons (e−) se movimente ao longo da superfície.

TANG, Q. et al. A Solar Cell that is Triggered by Sun and Rain Angewandte Chemie International Edition, n. 55, 2016 (adaptado).
Ao produzir eletricidade em dias chuvosos, o grafeno
- oxida os cátions dissolvidos na água da chuva.
- impede a difusão da água através das placas solares.
- diminui a energia de ativação da reação no pseudocapacitor.
- forma um compósito não metálico com os íons na água da chuva.
- gera uma diferença de potencial pela interação dos elétrons com os cátions.
34. (Enem 2024) Células a combustível microbianas (CCM) são capazes de gerar eletricidade a partir de águas residuárias urbanas e agroindustriais. As CCM são compostas de duas câmaras. Numa delas, contendo matéria orgânica, as bactérias eletrogênicas crescem formando um biofilme e se alimentam dos poluentes presentes no efluente. Ao se alimentarem, essas bactérias geram uma corrente elétrica que percorre o material sobre o qual se formam o biofilme. Um fio condutor externo possibilita a migração dessa corrente até uma segunda câmara, promovendo uma reação redox. A figura esquematiza uma CCM e as reações envolvidas.

CH3COO- (aq) + 2H2O(I) → 2 CO2 (g) + 7 H+ (aq) + 8 e-
4H+(aq) + O2(g) + 4e- → 2H2O (l)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
- CH3COO- (aq) + O2(g) → 2 CO2 (g) + 3 H+ (aq)
- CO2 (g) + O2(g) + H+ (aq) + H+ (g) → H2O(I) + CH3COO- (aq)
- CH3COO- (aq) + H+ (aq) + 2 O2(g) → 2 CO2(g) + 2 H2O (l)
- CH3COO- (aq) + 6 H2O (l) → 2 CO2 (g) 2 O2(g) + 15H+ (aq)
- 2 CO2 (g) + 11 H+ (aq) + O2 (g) → CH3COO- (aq) + 4 H2O (l)
35. (Enem 2023) Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio(II) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg2(NO3)2 dissolvidos em água. Temendo a toxicidade do mercúrio e sabendo que o Hg2Cl2 tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Hg2(NO3)2 (aq) + 2 NaCl (aq) → Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.


O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. o assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCI adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2(NO3)2 é 525 g mol-1, a do NaCl é 58 g mol-1 e a do Hg2Cl2 é 472 g mol-1.
Qual foi o gráfico obtido pelo assistente de laboratório?
36. (Enem PPL 2024) Pesquisadores da Universidade de Wisconsin-Madison, nos Estados Unidos, desenvolveram um dessalinizador-pilha.
O invento se mostrou muito promissor para dessalinizar água do mar, empregando eletrodos com bismuto e titânio em suas composições. Para realizar a dessalinização, o dispositivo funciona por eletrólise, conforme a figura. No descarregamento do dispositivo ocorre o processo inverso, que permite reaproveitar a energia, como em uma pilha.

Durante a dessalinização da água por eletrólise ocorre a formação de
- BiOCl no ânodo.
- H2 (g) no cátodo.
- Bi no polo positivo.
- O2 (g) no polo negativo.
- Na3 Ti2 (PO4)3 no ânodo.
37. (Enem PPL 2024) Na lavagem a seco, um solvente é considerado efetivo para limpeza de roupas quando evita o encolhimento dos tecidos, evapora facilmente e dissolve manchas lipofílicas, como óleos, ceras e gorduras em geral, por apresentar polaridade similar.
BORGES, L.; MACHADO, P. F. L. Lavagem a seco. Química Nova na Escola, n. 1, fev. 2013.
Qual estrutura molecular representa o solvente mais efetivo na lavagem a seco de roupas?
38. (Enem 2016) TEXTO I
Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos. Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito extremo at´o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza o acetato como substrato.
AQUINO NETO, S. Preparação e caracterização de bioanodos para biocélula a combustível etanol/O2. Disponível em: www.teses.usp.br. Acesso em: 23 jun. 2015 (adaptado).
TEXTO II
Em sistemas bioeletroquímicos, os potenciais padrão (E°') apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semirreações de redução e seus respectivos potenciais:
2 CO2 + 7 H+ 8 e- → CH3COO-+2H2O E°'= –0,3 V
O2 + 4H++4 e– → 2H2O E°' =0,8V
SCOTT, K.; YU, E. H. Microbial electrochemical and fuel cells: fundamentals and applications. Woodhead Publishing Series in Energy in energy n.88,2016(adaptado)
Nessas condições, qual é o número mínimo de biocélulas de acetato, ligadas em série, necessárias para se obter uma diferença de potencial de 4,4 V?
- 3
- 4
- 6
- 9
- 15
39. (Enem PPL 2016) Utensílios de uso cotidiano e ferramentas que contêm ferro em sua liga metálica tendem a sofrer processo corrosivo e enferrujar. A corrosão é um processo eletroquímico e, no caso do ferro, ocorre a precipitação do óxido de ferro(III) hidratado, substância marrom pouco solúvel, conhecida como ferrugem. Esse processo corrosivo é, de maneira geral, representado pela equação química:

Uma forma de impedir o processo corrosivo nesses utensílios é
- renovar sua superfície, polindo-a semanalmente.
- evitar o contato do utensílio com o calor, isolando-o termicamente.
- impermeabilizar a superfície, isolando-a de seu contato com o ar úmido.
- esterilizar frequentemente os utensílios, impedindo a proliferação de bactérias.
- guardar os utensílios em embalagens, isolando-os do contato com outros objetos.
40. (Enem PPL 2016) A obtenção do alumínio dá-se a partir da bauxita (Al2O3 3H2), que é purificada e eletrolisada numa temperatura de 1 000 °C. Na célula eletrolítica, o ânodo é formado por barras de grafica ou carvão, que são consumidas no processo de eletrólise, com formação de gás carbônico, e o cátodo é uma caixa de aço coberta de grafita.
A etapa de obtenção do alumínio ocorre no
- ânodo, com formação de gás carbônico.
- cátodo, com redução do carvão na caixa de aço.
- cátodo, com oxidação do alumínio na caixa de aço.
- ânodo, com depósito de alumínio nas barras de gráfica.
- cátodo, com o fluxo de elétrons das barras de grafita para a caixa de aço.
41. (Enem 2015) A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas.
Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (E°) para algumas semirreações de redução.

A equação química que representa a reação de formação da mancha avermelhada é:
- Ca2+ (aq) + 2 Cu+ (aq) → Ca (s) + 2 Cu2+ (aq).
- Ca2+ (aq) + 2 Fe2+ (aq) → Ca (s) 2 + Fe3+ (aq).
- Cu2+ (aq) + 2 Fe2+ (aq) → Cu (s) + 2 Fe3+ (aq).
- 3 Ca2+ (aq) + 2 Fe (s) → 3 Ca (s) + 2 Fe3+ (aq).
- 3 Cu2+ (aq) + 2 Fe (s) → 3 Cu (s) + 2 Fe3+ (aq).














