Química Inorgânica IV
Simulado com 15 exercícios de Química com gabarito sobre o tema Química Inorgânica IV com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Inorgânica IV.
1. (UFRGS) Considere as seguintes afirmações sobre o comportamento de ácidos em solução aquosa.
I - O grau de ionização de um ácido fraco, como o ácido acético, aumenta com o aumento da diluição.
II - A maior concentração de um ácido forte acarreta maior grau de ionização e maior constante de ionização.
III- A segunda constante de ionização de um ácido poliprótico é sempre menor que a primeira constante.
Quais estão corretas?
- Apenas I.
- Apenas II.
- Apenas III.
- Apenas I e III.
- I, II e III.
2. (UFRGS) Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
() A sílica, presente na areia, e o gás carbônico fazem parte da mesma função inorgânica: os óxidos.
() O número de oxidação do oxigênio, no composto OF2, é –2.
() O óxido de alumínio pode comportar-se como óxido ácido ou como óxido básico.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
- V – V – V.
- V – V – F.
- V – F – V.
- F – F – V.
- F – F – F.
3. (UEMG) Em relação às propriedades de ácidos e bases e às possíveis reações entre eles, assinale a alternativa correta.
- O hidróxido de alumínio, Al(OH)3, é uma base fraca, porém muito solúvel em água.
- A reação entre o ácido fosfórico e o hidróxido de cálcio forma o sal fosfato de cálcio, de fórmula Ca2(PO4)3.
- O hidróxido férrico possui a fórmula molecular Fe(OH)2.
- A reação entre hidróxido de potássio com hidróxido de sódio e ácido sulfúrico forma o sulfato duplo de potássio e sódio (KNaSO4)
4. (UFRGS) O ácido sulfúrico, um dos compostos mais importantes do ponto de vista industrial no mundo moderno, pode reagir com diversas substâncias.
Na coluna da esquerda abaixo, estão relacionadas substâncias que reagem com o ácido sulfúrico; na da direita, forças motrizes que favorecem a ocorrência das reações.
Associe a coluna da direita à da esquerda.
() KNO2
() Na2CO3
() Ba(NO3)2
1 - forma gás
2 - forma ácido fraco
3 - forma precipitado
4 - forma um sal básico
- 1 – 2 – 4.
- 1 – 3 – 2.
- 2 – 3 – 4.
- 2 – 1 – 3.
- 4 – 1 – 3.
5. (UECE) A água é o principal componente do sangue. Não é à toa que profissionais de saúde aconselham que se beba 8 copos de água por dia. Assim, quanto mais água ingerida, mais líquido vermelho corre nas veias. Isso aumenta o transporte de nutrientes por todo o corpo, inclusive para o cérebro, que tem suas funções otimizadas. Isso se dá não só porque o cérebro recebe mais nutrientes por meio do sangue, mas também porque certas reações químicas que acontecem nele, entre elas, a formação da memória, também dependem da presença da água para acontecer. A água atua como agente oxidante na seguinte equação:
- 2NaCℓ + H2O → Na2O + 2HCℓ.
- 3H2O + 2CO2 → C2H6O + 3O2.
- H2O2 + HNO2 → HNO3 + H2O.
- 2Na + 2H2O → 2NaOH + H2.
6. (UFRGS) O carbonato de cálcio é um sal encontrado em grande quantidade na natureza.
Na coluna da esquerda abaixo, são descritas 4 situações relacionadas ao carbonato de cálcio. Na coluna da direita, reações que representam adequadamente cada situação.
Associe adequadamente a coluna da esquerda à da direita.
1 - A decomposição térmica do calcário produz a denominada cal viva.
2 - A obtenção da cal extinta ocorre na reação entre cal viva e água.
3 - A cal extinta é usada em caiação para proteger paredes da umidade, pois reage com o CO2 formando uma película insolúvel.
4 - O carbonato de cálcio é praticamente insolúvel em água, embora se dissolva de forma apreciável em água que contém CO2 absorvido da atmosfera.
() CaCO3 + H2O + CO2 → Ca2+ + 2 HCO3-
() Ca(OH)2 + CO2 → CaCO3 + H2O
() CaO + H2O → Ca(OH)2
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
- 1 – 2 – 3.
- 2 – 4 – 1.
- 3 – 4 – 2.
- 4 – 3 – 2.
- 2 – 1 – 4.
7. (UFG) Sais são compostos iônicos que podem ser obtidos por meio de reação entre um ácido e uma base. Ao misturar soluções de ácido sulfúrico e hidróxido de cálcio, o sal formado é o
- CaSO4
- Ca(SO4)2
- Ca2SO4
- Ca2(SO4)3
- Ca3(SO4)2
8. (UENP) Leia o texto a seguir.
Há 76 anos, o dirigível Hindenburg explodiu no ar em Nova Jersey e, dos 100 passageiros, vários ficaram feridos e 35 morreram. Pesquisa recente identificou o motivo exato para o desastre: eletricidade estática. A partir de investigações com modelos em escala, pesquisadores chegaram à seguinte explicação para o acidente de 1937: o dirigível ficou carregado estaticamente, devido ao fato de ter atravessado uma tempestade. Somado a isso, também houve falha em uma das válvulas de gás hidrogênio. Quando foram pegas as cordas para o pouso, por conta da estática, causou-se uma faísca. Assim, o fogo se espalhou da cauda para as outras partes do dirigível facilitada pelo vazamento do hidrogênio.
(GALILEU. Causa para o acidente com o dirigível Hindenburg é descoberta 76 anos depois. Disponível em: <http://revistagalileu.globo.com/Revista/Common/0„EMI332611-17770,00.html>. Acesso em: 1 out. 2015.)
O gás presente no dirigível Hindenburg, quando ocorreu o acidente onde morreram 35 pessoas, era o gás hidrogênio. As reações a seguir apresentam algumas formas para obtenção desse gás.
H2O → H2 + O2
C + H2O → CO + H2
CH4 + H2O → CO2 + H2
Zn + HCl → ZnCl2 + H2
Assinale a alternativa correta que apresenta a soma dos coeficientes obtidos para o hidrogênio nas quatro reações, após o balanceamento. Observação: os coeficientes usados no balanceamento de uma equação química devem ser os menores números inteiros possíveis.
- 4
- 5
- 6
- 7
- 8
9. (UFRGS) Considere a curva de titulação mostrada na figura abaixo.
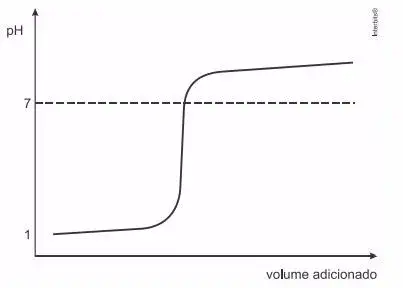
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
Trata-se de uma curva de titulação de ........ com ........ .
- ácido forte – base forte
- ácido forte – base fraca
- ácido fraco – base forte
- ácido fraco – base fraca
- base fraca – ácido forte
10. (UFAM) Um pedaço de fio de cobre, se for bem limpo com uma palha de aço, apresenta uma superfície brilhante. Mas se deixado exposto ao ambiente, em pouco tempo pode-se observar a formação de uma fina camada de um material sobre a superfície do metal. Com mais exposição, nova camada pode aparecer e menos do metal polido é possível ser observado. Dependendo da umidade relativa (vapor de água) e da poluição ambiental, novos produtos podem se formar sobre as camadas anteriores. Um processo químico de limpeza do material, removendo os produtos pouco solúveis, pode ser feito pela adição do cobre a uma solução aquosa de vinagre, que pode levar à formação de um complexo do íon cúprico com o ânion característico do vinagre, favorecendo a dissolução do óxido formado na superfície do metal. Com a adição de sal de cozinha ao vinagre, o processo é alterado, uma vez que o ânion do sal forma um complexo com o íon cuproso. As reações a seguir expressam os processos mencionados.
I. 2 CuO(s) + CO2(g) + H2O(l) ⇆ Cu2(CO3)(OH)2(s)
II. 2 Cu2O(s) + O2(g) ⇆ 4 CuO(s)
III. Cu+ (aq) + 2Cl- (aq) ⇆ [CuCl2] - (aq)
IV. 4 Cu(s) + O2(g) ⇆ 2 Cu2O(s)
V. Cu2+(aq) + Ac- (aq) ⇆ [CuAc]+ (aq)
Assinale a alternativa que indica a ordem de aparecimento dos processos reacionais:
- I, II, III, IV, V
- II, IV, I, V, III
- II, IV, V, I, III
- IV, II, I, V, III
- IV, II, I, III, V
11. (UFG) A série americana intitulada Breaking Bad vem sendo apresentada no Brasil e relata a história de um professor de Química. Na abertura da série, dois símbolos químicos são destacados em relação às duas primeiras letras de cada palavra do título da série. Considerando a regra do octeto, a substância química formada pela ligação entre os dois elementos é a:
- Ba2Br2
- Ba2Br3
- Ba2Br
- BaBr3
- BaBr2
12. (UECE) Os quatro tipos principais de funções inorgânicas são: ácido, base, sal e óxido. É comum a classificação dessas funções pelo tipo de íons que se formam quando o composto é dissolvido em água. Observe os compostos listados a seguir.
I. NH4OH
II. H3PO4
III. Ca3 (PO4)2
IV. Ca(OH)2
Sobre os compostos acima, assinale a afirmação correta.
- O composto I é uma base formada pela ionização do gás amoníaco (NH3) em água.
- O composto II é exemplo de óxido.
- O composto III é um sal que pode ser obtido a partir dos compostos II e IV.
- A reação de dissociação do composto II é H3PO4 + 3H2O → PO43– + 3H3O+.
13. (UFU) Em um laboratório de química, foram encontrados quatro recipientes contendo substâncias brancas sólidas. Sabe-se que os frascos contêm, separadamente: bicarbonato de sódio, sal de cozinha, açúcar refinado e pó de mármore (carbonato de cálcio). O técnico do laboratório testou a condutividade das respectivas soluções aquosas e sua reatividade em ácido clorídrico diluído.
Após os testes, o técnico verificou que o frasco que contém
- bicarbonato de sódio conduziu eletricidade em solução aquosa e gerou gás em contato com o ácido clorídrico.
- sal de cozinha conduziu eletricidade em água e reagiu com ácido clorídrico diluído, formando gás carbônico.
- açúcar conduziu eletricidade em solução aquosa, sem, entretanto, apresentar reatividade em contato com o ácido.
- pó de mármore não conduziu eletricidade em solução aquosa, nem tampouco reagiu com ácido clorídrico.
14. (UFRR) Assinale a única opção que possui a fórmula do ácido clorídrico, ácido sulfúrico, hidróxido de sódio, hidróxido de potássio e óxido de cálcio.
- HClO, H2S, SOH, POH, CaO2;
- HCl, H2SO4, NaOH, KOH, CaO;
- HCl, H2S, NaOH, KOH, CaO2;
- HClO, H2SO4, NaOH, KOH, CaO2;
- HCl, H2S, NaOH, KOH, CaO.
15. (UFAM PSC) Em um experimento em sala de aula, o professor usou três béqueres pequenos e colocou em dois deles duas soluções diferentes (uma em cada um) e no terceiro béquer água destilada, onde dissolveu um comprimido antiácido efervescente. Em seguida, a cada um dos béqueres ele adicionou 10 gotas de fenolftaleína, um indicador que fica incolor no meio ácido e rosa no meio básico. Ao adicionar em um dos béqueres (béquer 1) 10 gotas de hidróxido de sódio (0,1 mol/L), ele observou uma mudança de coloração para rosa, em outro béquer (béquer 2) ele adicionou 10 gotas de ácido clorídrico e observou mudança de coloração para incolor, mas no último béquer (béquer 3), adicionando ácido clorídrico ou hidróxido de sódio ele não observou qualquer mudança de cor, a não ser que adicionasse uma quantidade significativa destes reagentes. Após o experimento as seguintes observações foram feitas pelos alunos:
I. No béquer 1 havia ácido clorídrico, no béquer 2 havia hidróxido de sódio e no béquer 3 estava o comprimido efervescente dissolvido.
II. No béquer 1 havia hidróxido de sódio, no béquer 2 havia ácido clorídrico e no béquer 3 estava o comprimido efervescente dissolvido.
III. No béquer 1 havia ácido clorídrico, no béquer 2 estava o comprimido efervescente dissolvido e no béquer 3 havia hidróxido de sódio.
IV. Nos béqueres 1 e 2 a mudança de cor foi porque houve uma reação de neutralização com mudança brusca de pH do meio, enquanto no béquer 3 a cor se manteve porque a solução formada era uma solução tampão, que resiste por mais tempo a mudança no pH.
Assinale a alternativa correta:
- Somente a observação I está correta
- Somente as observações I e IV estão corretas
- Somente as observações II e IV estão corretas
- Somente as observações III e IV estão corretas
- Somente a observação IV está correta