Química Inorgânica III
Simulado com 15 exercícios de Química com gabarito sobre o tema Química Inorgânica III com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Inorgânica III.
01. (UEFS) ClO–(aq) + I–(aq) + H+(aq) → Cl–(aq) + I2(s) + H2O(l)
Um dos métodos para determinar a concentração de íons hipoclorito na água sanitária envolve a reação de oxirredução representada de maneira simplifica pela equação iônica não balanceada.
Após o balanceamento da equação química com os menores coeficientes inteiros, é correto concluir:
- O total da carga dos íons reagentes é menor do que a carga relacionada aos produtos, na equação química.
- A reação entre 2,0mol de íons hipoclorito com iodeto suficiente, em meio ácido, leva à produção de 254,0g de iodo.
- O íon iodeto atua como agente oxidante porque o estado de oxidação do iodo diminui no final do processo de oxirredução.
- A quantidade aproximada de 3,6.1023 íons cloreto obtida no processo de oxirredução, revela a presença de 0,6mol de íons hipoclorito em uma amostra analisada.
- O valor da soma dos coeficientes dos ânions reagentes é maior do que a dos coeficientes dos produtos da equação de oxirredução.
02. (UECE) Um material sólido, de cor acinzentada, quando posto em contato com a chama do bico de Bunsen, deu origem a um pó branco que, misturado à água com algumas gotas de uma substância halocrômica (indicador), revelou uma coloração vermelha. Quando este produto reagiu em condições estequiométricas adequadas com um ácido, a coloração vermelha desapareceu. Considerando essas informações, assinale a única afirmação verdadeira.
- Estão envolvidos no processo: um elemento, uma substância simples e duas substâncias compostas.
- As sucessivas mudanças de cores nos sugerem que houve a formação de um hidróxido e, posteriormente, a formação de um sal.
- Os procedimentos descritos acima envolvem três reações químicas: uma combustão, uma análise e uma dupla troca.
- A reação do pó branco com a água só ocorre porque é catalisada pelo indicador que confere a cor vermelha ao sistema.
03. (UEG) O óxido de cálcio e o dióxido de carbono são obtidos pelo aquecimento do carbonato de cálcio, conforme a equação química a seguir.
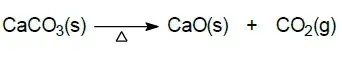
No processo químico apresentado ocorre
- síntese de espécie química envolvida na fotossíntese.
- formação de molécula com geometria angular.
- obtenção de composto metálico.
- produção de óxido anfótero.
- reação de oxidação.
04. (UESB)

O transporte pelas estradas brasileiras de mais de 3,5 mil tipos de substâncias químicas diferentes exige conhecimento e cuidados específicos. Os caminhões que transportam essas substâncias químicas devem ser sinalizados com um painel de segurança, como o da ilustração I, na qual os três algarismos superiores indicam o número de risco, que correspondem, respectivamente, à classe dos gases, dos tóxicos e dos corrosivos no exemplo mencionado, e os algarismos inferiores, que indicam o número da ONU correspondente à amônia anidra. Além do painel de segurança, um rótulo em losango, ilustração II, contém a descrição da natureza do produto e o número de sua classe ou subclasse de risco. Entre os mais conhecidos, estão os líquidos inflamáveis, representados por uma chama como, na figura, os corrosivos, cuja representação acentua o perigo no contato com a pele, e os tóxicos, cujo símbolo é uma caveira.
Considerando-se essas informações e as propriedades das substâncias químicas, é correto afirmar:
- A amônia anidra, NH3(g), é uma substância tóxica porque, em contato com a água, produz íons H3O+(aq).
- O caminhão que transporta o ácido sulfúrico, H2SO4(aq), deve apresentar o símbolo indicativo de líquido corrosivo e oxidante.
- Os problemas causados pelo derramamento de hidróxido de sódio, NaOH(s), no solo são eliminados com a dissolução da substância em água.
- A utilização de cal, CaO(s), para cobrir substâncias oxidantes, como o hipoclorito de sódio, NaClO(s), é suficiente para evitar a contaminação ambiental.
- O nitrato de potássio, KNO3(s), utilizado na produção de fertilizantes, quando derramado próximo a córregos, não causa danos ambientais porque esse sal é insolúvel em água.
05. (UEFS) O ácido bórico, H3BO3, em baixas concentrações, é utilizado no tratamento de infecções do canal auditivo externo, inflamação nos olhos, irritação da pele, irritação dos olhos, picada de insetos e queimaduras leves. Entretanto, em algumas pessoas, o contato com o ácido bórico pode causar reações alérgicas, irritação nos olhos e do sistema respiratório. Em doses elevadas, o ácido bórico é frequentemente utilizado como inseticida para matar baratas, formigas, pulgas e muitos outros insetos.
Sobre o ácido bórico, é correto afirmar:
- É um ácido fraco e pode ser preparado pela reação de B2O3 com água.
- O átomo de boro, nesse composto, realiza seis ligações covalentes simples e possui geometria molecular igual a do SF6.
- O átomo de boro, nesse composto, possui oito elétrons na camada de valência e, com isso, possui seu subnível de energia p preenchido com seis elétrons.
- A reação de neutralização desse ácido com hidróxido de cálcio produz CaBO3 e água.
- Nesse composto, o átomo de boro, por ser menos eletronegativo que o oxigênio, doa seus elétrons de valência aos átomos de oxigênio, atingindo assim uma configuração de gás nobre.
06. (UFN) O ácido fórmico (HCOOH), liberado através do contato com os pelos finos das folhas de uma série de plantas da família das Urticáceas, produz irritações na pele. Qual dos produtos de acesso doméstico abaixo poderia ser utilizado para diminuir essa irritação com maior efetividade?
- Vinagre (solução de ácido acético)
- Leite de Magnésia (suspensão de hidróxido de magnésio)
- Álcool
- Óleo de soja
- Água
07. (UEMG)

A personagem da tirinha de humor mandou cuspir a subtância porque uma importante propriedade do ácido sulfúrico é ser
- amargo.
- cáustico.
- venenoso.
- corrosivo.
08. (UFG) Certos alimentos, ao serem cortados, sofrem um processo de escurecimento em sua superfície, como a maçã e o palmito. Para retardar esse fenômeno, costuma-se passar suco de limão nas superfícies desses alimentos. A função do suco de limão, nesse caso, é a de
- coagulante.
- hidratante.
- antiumectante
- antibactericida.
- antioxidante.
09. (UEA) Cloreto de cálcio anidro, substância utilizada como secante (antimofo vendido em supermercados), pode ser obtido pelas seguintes transformações:
etapa 1 (reação química):
Ca(OH)2 (s) + 2HCl (aq) → CaCl2 (aq) + 2H2O (l)
etapa 2 (evaporação e secagem):
CaCl2 (aq) → CaCl2 (s) + nH2O (g)
O cloreto de cálcio anidro é classificado como ________ e é obtido por uma reação química de _________.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
- sal – neutralização
- sal – oxirredução
- ácido – oxirredução
- base – neutralização
- ácido – neutralização
10. (UFRGS) Em ambientes fechados, tais como submarinos e espaçonaves, há necessidade de eliminar o gás carbônico produzido pela respiração. Para evitar esse acúmulo de gás carbônico, podem ser utilizados diferentes métodos.
Abaixo são apresentados dois desses métodos, com suas respectivas reações.
Método 1: uso de hidróxido de lítio
CO2 + 2 LiOH → Li2CO3 + H2O
Método 2: reação com óxido de cálcio
CO2 + CaO → CaCO3
Sobre as reações e os reagentes envolvidos nesses métodos, pode-se afirmar que
- ambas reações originam sais insolúveis em água.
- todas as substâncias participantes dessas reações são iônicas.
- o carbonato de lítio é uma substância que, quando dissolvida em meio aquoso, produz solução básica.
- todos os compostos participantes dessa reação são óxidos.
- ambas reações produzem a mesma massa de sal, quando consomem iguais quantidades de CO2.
11. (UFRGS) O governo francês estabeleceu, no século XVIII, um prêmio para quem criasse um processo simples de transformação de sal comum em carbonato de sódio (barrilha). Assim, Nicolas Leblanc desenvolveu um processo que pode ser representado pela sequência de reações abaixo, já balanceadas.
1 - 2 NaCL(s) + H2SO4 (aq) → Na2SO4 (s) + 2 HCL(g)
2 - Na2SO4 (s) + 4 C (s) → X + 4 CO (g)
3 - Na2S (s) + CaCO3 (s) → Y + CaS (s)
Nessa sequência de reações, os produtos X e Y são, respectivamente,
- Na2S e Na2O.
- Na2S e Na2CO3.
- NaS2 e NaCO3.
- Na2SO3 e NaCO3.
- NaS2 e Na2CO3.
12. (UEMA) O NO2 e o SO2 são gases causadores de poluição atmosférica que, dentre os danos provocados, resulta na formação da chuva ácida quando esses gases reagem com as partículas de água presentes nas nuvens, produzindo HNO3 e H2SO4. Esses compostos, ao serem carreados pela precipitação atmosférica, geram transtornos, tais como contaminação da água potável, corrosão de veículos, de monumentos históricos etc.
Os compostos inorgânicos citados no texto correspondem, respectivamente, às funções
- sais e óxidos.
- bases e sais.
- ácidos e bases.
- bases e óxidos.
- óxidos e ácidos.
13. (UEA) Em um laboratório, um resíduo químico constituído por ácido sulfúrico (H2SO4) foi neutralizado com solução de hidróxido de sódio (NaOH), obtendo-se como produtos de reação água e o sal Na2SO4. A somatória dos índices estequiométricos da equação balanceada desta reação de neutralização é
- 7.
- 5.
- 6.
- 8.
- 4.
14. (UEFS) O ácido sulfúrico, H2SO4(aq), o óxido de cálcio, CaO(s), o etileno, C2H4(g) e o cloro, Cl2(g), estão entre as substâncias mais produzidas pela indústria química porque são intermediários para a produção de fertilizantes, detergentes, plásticos e desinfetantes.
Considerando-se as informações, a estrutura e as propriedades dessas substâncias químicas, é correto afirmar:
- O óxido de cálcio é um composto molecular solúvel em água.
- A produção do etileno envolve hidrogenação catalítica do etano, um derivado do petróleo.
- O hidrocarboneto de fórmula C2H4 tem cadeia carbônica saturada e é constituído por moléculas polares.
- O ácido sulfúrico é um ácido diprótico utilizado na produção do sulfato de amônio, (NH4)2SO4(s).
- A ação bactericida do cloro, quando dissolvido em água, está associada ao ácido clorídrico produzido na reação entre o gás e a água.
15. (UFRGS) Os xampus têm usualmente, como base de sua formulação, um tensoativo aniônico, como o laurilsulfato de sódio [CH3(CH2)11OSO2O-Na+]. Cloreto de sódio é adicionado na faixa de 0,2 a 0,6% para aumentar a viscosidade dos xampus. Nos últimos anos, têm aparecido no mercado muitos xampus com a denominação sem sal. O asterisco indica que não foi adicionado cloreto de sódio. Nesses casos, normalmente pode ser usado o cloreto de potássio como agente espessante.
Considere as afirmações abaixo, sobre a situação descrita.
I - Se um xampu contém laurilsulfato de sódio, então necessariamente ele contém um sal na sua composição.
II - Se um xampu contém laurilsulfato de sódio e cloreto de potássio na sua formulação, então, apesar de não ter sido adicionado cloreto de sódio, o produto final contém ânions cloreto e cátions sódio.
III - A semelhança entre o laurilsulfato de sódio e o cloreto de sódio é que ambos apresentam o mesmo ânion.
Quais estão corretas?
- Apenas I.
- Apenas II.
- Apenas III.
- Apenas I e II.
- I, II e III.