Química Geral II
Lista de 15 exercícios de Química com gabarito sobre o tema Química Geral II com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Geral II.
01. (CN) Considere os seguintes métodos de separação de misturas.
I - Método com base na densidade.
II - Método com base no tamanho das partículas.
III - Método com base nas temperaturas de ebulição.
As definições acima se referem, respectivamente, a:
- I - decantação; II - peneiração; III - destilação
- I - flotação; II - destilação; III - decantação.
- I - filtração; II - catação; III - destilação.
- I - flotação; II - tamização; III - sublimação.
- I - decantação; II - destilação; III - filtração.
Resposta: A
Resolução:
02. (EsPCEx) Analise as afirmações I, II, III e IV abaixo referente(s) à(s) característica(s) e/ou informação(ões) sobre algumas substâncias, nas condições ambientes:
I- A substância é a principal componente do sal de cozinha e pode ser obtida pela evaporação da água do mar. Dentre seus muitos usos podemos citar: a produção de soda cáustica e a conservação de carnes.
II- A substância é classificada como composta, e pode fazer parte da chuva ácida. Dentre seus muitos usos, podemos citar: utilização em baterias de automóveis e na produção de fertilizantes, como o sulfato de amônio.
III-A substância em solução aquosa é vendida em drogarias e utilizada como antisséptico e alvejante. Algumas pessoas utilizam essa substância para clarear pelos e cabelos.
IV-A substância é classificada como simples, tem seu ponto de ebulição igual a -195,8 0C, é a mais abundante no ar atmoférico e reage com o gás hidrogênio produzindo amônia.
As substâncias que correspondem às afirmações I, II, III e IV são, respectivamente,
- cloreto de sódio, ácido sulfúrico, permanganato de potássio, dióxido de enxofre
- cloreto de sódio,ácido clorídrico, peróxido de hidrogênio, dióxido de carbono
- cloreto de sódio, ácido muriático, óxido férrico, gás oxigênio
- cloreto de sódio, ácido sulfúrico, peróxido de hidrogênio, gás nitrogênio
- sulfato de alumínio, ácido muriático, óxido ferroso, gás nitrogênio
Resposta: D
Resolução:
03. (EPCAR) Um líquido L1 de densidade 800 g/l será misturado a um líquido L2 de densidade 900 g/l Tal mistura será homogênea e terá a proporção de 3 partes de L1 para cada 5 partes de L2 A densidade da mistura final, em g/l, será
- 861,5
- 862
- 862,5
- 863
Resposta: C
Resolução:
04. (EsPCEx) Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm · L · mol-1 · K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
- I, II e III.
- II e III.
- III e IV.
- II e IV.
- II, III e IV.
Resposta: D
Resolução:
05. (EAM) De modo geral, os compostos que têm ligações covalentes:
- são formados pela ligação entre metais e o hidrogênio.
- são encontrados na natureza somente nos estados líquido e gasoso.
- são constituldos de átomos com tendência exclusiva em doar elétrons.
- formam estruturas eletricamente neutras denominadas moléculas.
- apresentam alta condutividade elétrica em todos os estados físicos.
Resposta: D
Resolução:
06. (EsPCEx) “O tungstênio é encontrado em vários minerais, como óxidos de volframita – (Fe, Mn) WO4, e a scheelita – CaWO4. É usado em filamentos de lâmpadas incandescentes, em tanques de guerra, balas de revólver e em ferramentas de corte e perfuração”.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 207.
Acerca da espécie química CaWO4 e seus átomos constituintes, são feitas as seguintes afirmativas:
I – No composto CaWO4 o número de oxidação (Nox) do tungstênio é +6.
II – O composto CaWO4 é considerado um peróxido.
III – O CaWO4 é uma substância que possui apenas ligações do tipo covalente.
IV – O tungstênio (Z=74) é um metal de transição externa (“elementos com configuração eletrônica terminando em ns2 (n-1)d1 até 10”).
FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 206. Das afirmativas feitas estão corretas apenas
- I e II.
- II e III.
- III e IV.
- I e IV.
- I, II e III.
Resposta: D
Resolução:
07. (EsPCEx) Considere que a reação de cobre metálico com ácido nítrico diluído produz, nas CNTP, um volume gasoso de 181,6 L de óxido de nitrogênio II (NO), água e nitrato de cobre II.
Nesse caso, a soma dos coeficientes estequiométricos da equação corretamente balanceada dessa reação completa e a massa de cobre consumida são, respectivamente,
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L
- 18 e 1222 g.
- 20 e 768 g.
- 16 e 154 g.
- 20 e 650 g.
- 18 e 402 g.
Resposta: B
Resolução:
08. (EAM) Um gás ideal sofre uma transformação isobárica cuja pressão é 10 N/m², alterando de volume de 2 m³ para 6 m³.
Sendo assim, assinale a opção que fornece o trabalho, em joules, realizado pelo gás sobre o ambiente.
- 10
- 20
- 30
- 40
- 50
Resposta: D
Resolução:
09. (EsPCEx) Na ânsia pelo “elixir da longa vida”, por volta do século I, alquimistas descobriram acidentalmente a Pólvora, referenciada em textos de Alquimia pelos avisos quanto aos cuidados para não se misturarem certos materiais uns com os outros. A pólvora, mais conhecida desde o final do século XIX como pólvora negra, é uma mistura química que queima com rapidez. Foi extensamente utilizada como propelente em canhões e armas de fogo e atualmente ainda é empregada em artefatos pirotécnicos. Nitrato de potássio, enxofre e carvão (carbono) são os constituintes da pólvora negra. Sobre as espécies constituintes da pólvora negra afirma-se que
Dados:
Número Atômico: K = 19; N = 7; O = 8; S = 16; C = 6
I – o nitrato de potássio é classificado como uma base segundo a teoria de Arrhenius;
II – a 25 ºC e 1 atm a variedade alotrópica mais estável do carbono é a grafite e a do enxofre é a rômbica;
III – a fórmula do nitrato de potássio é KNO2 ;
IV – o enxofre é um metal radioativo que pertence à família 6A (16) da tabela periódica;
V – o átomo de carbono (6C) estabelece 4 ligações químicas e possui a variedade alotrópica diamante, substância natural de alta dureza;
Estão corretas apenas as afirmativas
- I e IV.
- II e V.
- III, IV e V.
- I, II e V.
- II, III e IV
Resposta: B
Resolução:
10. (CN) Analise o gráfico de aquecimento de uma substância representado na figura abaixo.
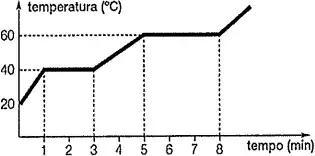
Sendo assim, é correto afirmar que:
- quando t = 2 minutos, tem-se um sistema bifásico.
- quando t = 4 minutos, coexistem substância sólida e substância líquida.
- quando t = 1 minuto, inicia-se a liquefação da substância.
- a substância tem ponto de fusão igual a 60ºC.
- no intervalo de 5 a 8 minutos, a substância encontra-se totalmente na forma de vapor.
Resposta: A
Resolução:
11. (EsPCEx) Durante um experimento, um gás perfeito é comprimido, adiabaticamente, sendo realizado sobre ele um trabalho de 800 J. Em relação ao gás, ao final do processo, podemos afirmar que:
- o volume aumentou, a temperatura aumentou e a pressão aumentou.
- o volume diminuiu, a temperatura diminuiu e a pressão aumentou.
- o volume diminuiu, a temperatura aumentou e a pressão diminuiu.
- o volume diminuiu, a temperatura aumentou e a pressão aumentou.
- o volume aumentou, a temperatura aumentou e a pressão diminuiu.
Resposta: D
Resolução:
12. (CN) De modo geral, os compostos que possuem ligações iônicas:
- são formados pela ligação entre ametais e o hidrogênio.
- são encontrados na natureza no estado líquido.
- apresentam baixos pontos de fusão e ebulição.
- são duros e resistentes a impactos.
- apresentam alta condutividade elétrica em solução aquosa.
Resposta: E
Resolução:
13. (EsPCEx) No ano de 2014, os alunos da EsPCEx realizaram um experimento de eletrólise durante uma aula prática no Laboratório de Química. Nesse experimento, foi montado um banho eletrolítico, cujo objetivo era o depósito de cobre metálico sobre um clipe de papel, usando no banho eletrolítico uma solução aquosa 1 mol·L-1 de sulfato de cobre II. Nesse sistema de eletrólise, por meio de uma fonte externa, foi aplicada uma corrente constante de 100 mA, durante 5 minutos. Após esse tempo, a massa aproximada de cobre depositada sobre a superfície do clipe foi de:
Dados: massa molar Cu = 64 g/mol; 1 Faraday = 96500 C
- 2,401 g.
- 1,245 g.
- 0,987 g.
- 0,095 g.
- 0,010 g.
Resposta: E
Resolução:
14. (EsPCEx) Compostos contendo enxofre estão presentes, em certo grau, em atmosferas naturais não poluídas, cuja origem pode ser: decomposição de matéria orgânica por bactérias, incêndio de florestas, gases vulcânicos etc. No entanto, em ambientes urbanos e industriais, como resultado da atividade humana, as concentrações desses compostos é alta. Dentre os compostos de enxofre, o dióxido de enxofre (SO2) é considerado o mais prejudicial à saúde, especialmente para pessoas com dificuldade respiratória.
(Adaptado de BROWN, T.L. et al, Química a Ciência Central. 9ª ed, Ed. Pearson, São Paulo, 2007)
Em relação ao composto SO2 e sua estrutura molecular, pode-se afirmar que se trata de um composto que apresenta
Dado: número atômico S = 16 ; O = 8
- ligações covalentes polares e estrutura com geometria espacial angular.
- ligações covalentes apolares e estrutura com geometria espacial linear.
- ligações iônicas polares e estrutura com geometria espacial trigonal plana.
- ligações covalentes apolares e estrutura com geometria espacial piramidal.
- ligações iônicas polares e estrutura com geometria espacial linear.
Resposta: A
Resolução:
15. (EsPCEx) A representação a seguir corresponde à parte superior da tabela periódica, na qual as letras não correspondem aos verdadeiros símbolos dos elementos.
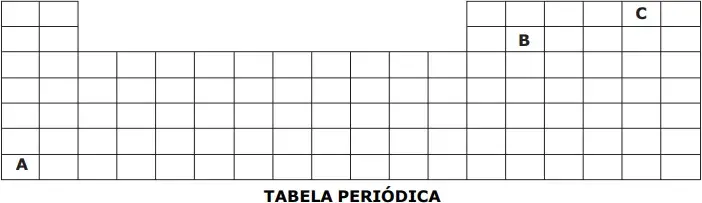
Considere as afirmativas acerca dos elementos hipotéticos (A, B, C) apresentados na Tabela Periódica.
I – Dentre os elementos hipotéticos, o elemento A é o de maior afinidade eletrônica (“energia liberada quando um átomo isolado, no estado gasoso, captura um elétron”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
II – Dentre os elementos hipotéticos, pode-se afirmar que o elemento B é o de maior eletropositividade (“capacidade de um átomo perder elétrons, originando cátions”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 203.
III – Dentre os elementos hipotéticos, pode-se afirmar que o elemento C é o mais eletronegativo (“força de atração exercida sobre os elétrons de uma ligação”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
Das afirmativas feitas está(ão) correta(s) apenas
- I.
- II.
- III.
- I e II.
- II e III.
Resposta: C
Resolução: