Pilha seca de Leclanché ou pilha ácida
Lista de 06 exercícios de Química com gabarito sobre o tema Pilha seca de Leclanché ou pilha ácida com questões de Vestibulares.
01. (PUCCamp) Nas pilhas secas, geralmente utilizadas em lanternas, há um envoltório de zinco metálico e um bastão central de grafite rodeado de dióxido de manganês e pasta úmida de cloreto de amônio e de zinco, conforme a figura a seguir.

As reações são complexas, porém, quando o fluxo de corrente é pequeno, as reações podem ser apresentadas por:
Ânodo: 1 Zn → 2 e- + 1 Zn2+
Cátodo: 2 MnO2+ 2 NH41+ + 2e- → Mn2O3(s) + 2 NH3 + H2O
À medida que a pilha seca vai sendo gasta, há aumento nas massa
- zinco metálico e água.
- dióxido de manganês.
- sais de amônio e de zinco.
- zinco metálico e dióxido de manganês.
- amônia, água, sais de zinco e óxido de manganês III.
02. (UNIFOR) A pilha seca ácida foi desenvolvida em 1866, pelo químico francês George Leclanché (1839-1882). Tratase de uma pilha comum hoje em dia, pois é a mais barata sendo usada em lanternas, rádios, equipamentos portáteis e aparelhos elétricos como gravadores, flashes e brinquedos. Essa pilha na verdade não é seca, pois dentro dela há uma pasta aquosa, úmida.
(Fonte: http://www.mundoeducacao.com/quimica/pilha-seca-leclanche.htm)

Sobre a referida reação é possível afirmar que
- No anodo, ocorre a oxidação do zinco metálico que fica no envoltório da pilha segundo a reação: Zn (s) → Zn2+ (aq) + 2 e-. Os 2 elétrons do Zn metálico oxidado são transferidos para o dióxido de manganês que assim é convertido a trióxido de manganês.
- O dióxido de manganês sofre oxidação sendo convertido a trióxido de manganês e portanto age como agente redutor no processo.
- Zinco metálico sofre oxidação no catodo e geram a corrente de 1,5 V típica destas pilhas.
- Dióxido de manganês sofrem redução no anodo e geram a corrente de 1,5 V típica destas pilhas.
- No catodo, ocorre a oxidação do zinco metálico que fica no envoltório da pilha segundo a reação: Zn (s) → Zn2+ (aq) + 2 e-. Os 2 elétrons do Zn metálico reduzido são transferidos para o dióxido de manganês que assim é convertido a trióxido de manganês.
03. (IFSul) Leia o texto abaixo e responda à questão.
As pilhas, fontes de energia elétrica tão comuns nos nossos dias, tiveram sua denominação a partir de um experimento realizado por Alessandro Volta em 1800, que consistia no empilhamento alternado de discos de Cu (Ered= -0,34V) e Zn (Ered= +0,76V), intercalados por feltro impregnado com solução ácida, conforme mostra a figura abaixo:

O cátodo na pilha montada por Volta é o
- Zn, pois é o polo negativo.
- Cu, pois é o polo positivo.
- Zn, pois apresenta maior potencial de redução.
- Cu, pois apresenta menor potencial de redução.
04. (CESMAC) A pilha seca foi inventada e patenteada em 1866 pelo engenheiro francês Georges Leclanché. A pilha de Leclanché é a precursora das pilhas secas modernas, podendo ser utilizadas em lanternas, rádios portáteis, gravadores, brinquedos etc. As reações que ocorrem na pilha seca são as seguintes:
No cátodo:

Qual é a máxima variação de potencial (ΔE) obtida nesta pilha?
- - 0,036 V
- - 1,500 V
- 1,500 V
- - 0,036 V
- 1,400 V
05. (UFSM) Observe a figura:
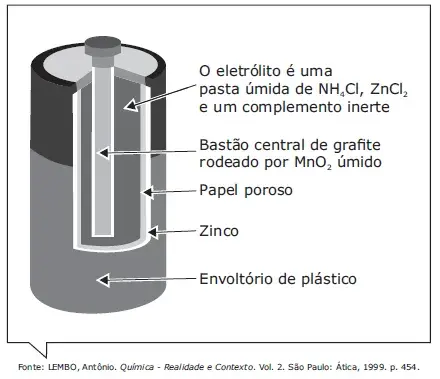
A pilha seca comum, utilizada em rádios, lanternas e brinquedos eletrônicos, é uma adaptação da pilha de Leclanché e utiliza, como meio eletrolítico, uma pasta umedecida contendo sais, como o cloreto de amônio e o cloreto de zinco.

Então, é possível afirmar:
I - O Zn se reduz e o Mn se oxida.
II - A diferença de potencial da pilha é de 1,5 V.
III - A reação global que ocorre na pilha é:
2MnO2 (s) + 2NH4Cl (aq) + Zn (s) → Mn2O3 (s) + H2O (l) + 2NH3 + ZnCl2 (aq)
IV - À medida que a pilha vai sendo consumida (gasta), há aumento nas massas de dióxido de manganês e água.
Estão corretas
- apenas I e II.
- apenas I e III.
- apenas II e III.
- apenas II e IV.
- apenas III e IV.
06. (UNIFENAS) A pilha comum de lanterna, conhecida como pilha seca, foi inventada em 1866 pelo engenheiro francês George Leclanché. A expressão pilha seca é apenas uma designação comercial que foi criada há muitos anos para diferenciar esse tipo de pilha (revolucionário, na época) das pilhas então conhecidas, que utilizavam recipientes com soluções aquosas, como a Pilha de Daniel.
As semirreações que ocorrem nessa pilha são:
(I) Zn(s) → Zn+2 (aq) + 2e-
(II) 2 MnO2(s) + 2NH4 + (aq) + 2e- → Mn2O3(s) + 2 NH3(g) + H2O(l)
É correto afirmar que
- o Zn(s) é o polo positivo desta pilha.
- os elétrons migram do cátodo para o ânodo.
- o agente oxidante da célula será o Mn2O3.
- é um processo não-espontâneo.
- no cátodo ocorre a redução do MnO2.