Baterias ou Pilhas Recarregáveis
Lista de 14 exercícios de Química com gabarito sobre o tema Baterias ou Pilhas Recarregáveis: Baterias de chumbo (automóveis), bateria de celular (bateria de íon lítio), pilha ou bateria de níquel/cádmio, bateria de hidreto metálico/óxido de níquel (NiMH) com questões de Vestibulares.
1. (CESMAC) As células de pilhas de níquel-cádmio (NiCd) foram inventadas no século 19. Entre as tecnologias de baterias recarregáveis, a de NiCd perdeu participação no mercado para as baterias NiMH e Li-ion, devido à sua capacidade inferior e ao impacto ambiental causado pelo descarte deste material no meio ambiente. De acordo com os potenciais padrões de redução descritos abaixo, para as reações que ocorrem na pilha NiCd:
NiO(OH) + H2O + e– → Ni(OH)2 + OH− E° = + 0,49 V
Cd(OH)2 + 2e– → Cd + 2 OH− E° = - 0,81 V
qual é a variação de potencial (ΔE°) desenvolvido por esta pilha?
- -0,32 V
- +1,30 V
- +2,11 V
- -1,30 V
- -2,11 V
02. (PUC-SP) As pilhas de níquel-cádmio (“ni-cd”) são leves e recarregáveis, sendo utilizadas em muitos aparelhos portáteis, como telefones e câmaras de vídeo. Essas pilhas têm como característica o fato de os produtos formados durante a descarga serem insolúveis e ficarem aderidos nos eletrodos, permitindo a recarga quando ligada a uma fonte externa de energia elétrica.
Com base no texto e nas semirreações de redução fornecidas a seguir, a equação que melhor representa o processo de descarga de uma pilha de níquel-cádmio é:

- Cd(s) + 2 Ni(OH)3(s) → Cd(OH)2(s) + 2 Ni(OH)2(s)
- Cd(s) + Ni(s) → Cd2+(aq) + Ni2+(aq)
- Cd(OH)2(s) + 2 Ni(OH)2(s) → Cd(s) + Ni(s)
- Cd2+(aq) + Ni2+(aq) → Cd(s) + Ni(s)
- Cd(s) + Ni(s) + 2OH-(aq) → Cd(OH)2(s) +Ni2+(aq)
03. (FMABC)As pilhas de níquel-cádmio (NiCad) são recarregáveis, tendo grande aplicação em aparelhos portáteis. A partir dos potenciais padrão do hidróxido de cádmio e do dióxido de níquel a seguir, foram feitas algumas afirmações.
Cd(OH)2(s) + 2 e- → Cd(s) + 2 OH- (aq) Eºred = -0,81 V
NiO2(s) + 2 H2O(l) + 2 e- → Ni(OH)2(s) + 2 OH- (aq) Eºred = +0,49 V
Dado: constante de Faraday = 96000 C
I. a ddp da pilha é de 0,32 V.
II. A reação de descarga da pilha pode ser representada pela equação:
NiO2(s) + 2 H2O(ℓ) + Cd(s) → Cd(OH)2(s) + Ni(OH)2(s)
III. Para produzir uma corrente 1,6 mA por 1000 s são consumidos aproximadamente 112 mg de cádmio metálico.
Sobre essas sentenças pode-se afirmar que
- apenas a I é verdadeira.
- apenas a II é verdadeira.
- apenas a I e a III são verdadeiras.
- apenas a II e a III são verdadeiras.
- todas são verdadeiras.
04. (Covest) - As pilhas de níquel-cádmio, que viabilizaram o uso de telefones celulares e computadores portáteis, são baseadas na seguinte reação:
Cd(s) + NiO2(s) + H2O(l) → Cd(OH)2(s) + Ni(OH)2(s).
Considerando este processo, quantos mols de elétrons são produzidos por mol de cádmio consumido?
- 0,5.
- 1.
- 2.
- 3.
- 4.
05. (UNESP) A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos eletrônicos, apresenta a seguinte reação de oxirredução
Cd (s) + NiO2 (s) + 2 H2O (l) → Cd(OH)2 (s) + Ni(OH)2 (s)
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
- H2O(s), Cd(OH)2(s)
- NiO2(s), Cd(OH)2(s)
- NiO2(s), Cd(s)
- Cd(s), Cd(OH)2(s)
- NiO2(s), Ni(OH)2(s)
06. (UP) As baterias de níquel-cádmio (Ni-Cd) foram bastante utilizadas até o final dos anos 1990, porém, devido à toxidez do cádmio e ao efeito memória que abrevia sua vida útil, foram substituídas por baterias de níquel-metal-hidreto (NiMH). As reações eletroquímicas, não balanceadas, que representam a descarga das baterias Ni-Cd são:
Cd(s) + OH– (aq.) → Cd(OH)2(s) + 2e–
NiO(OH)(s) + H2O(l) + 2e– → Ni(OH)2(s) + OH– (aq.)
Em relação ao assunto, assinale a alternativa correta.
- O Cd(s) é o cátodo da pilha.
- O coeficiente estequiométrico do Cd(OH)2(s) na equação global é 2.
- O Cd(s) é reduzido.
- O NiO(OH)(s) é oxidado.
- O NiO(OH)(s) é o polo positivo.
07. (Uneb) O cátodo da célula eletroquímica é formado por óxido de lítio e de cobalto, LiCoO2(s), e o ânodo, por grafite, quando a bateria está descarregada. Durante a recarga, a corrente elétrica é invertida, e os íons de lítio são reduzidos no eletrodo de grafite. Na descarga, os íons de lítio, Li+, deixam a grafite, após reação e voltam a formar óxido de lítio e de cobalto. Com base nas informações do texto, das figuras e considerando-se o funcionamento de célula eletroquímica e a força eletromotriz de célula igual a 3,7 V, é correto afirmar:
- O eletrólito é uma solução aquosa de sal de lítio.
- O óxido de LiCoO2 é oxidado a CoO2, na recarga da pilha.
- A oxidação e a redução ocorrem, respectivamente, no cátodo e no ânodo, durante a descarga da pilha.
- A voltagem de bateria, formada a partir da ligação em paralelo de quatro células eletroquímicas de óxido de lítio-cobalto, é, aproximadamente, 15 V.
- A ligação entre o cátodo e o ânodo através do separador, por meio de partículas metálicas, desvia o fluxo de corrente elétrica e causa resfriamento da célula eletroquímica.
08. (Uel) Baterias de íon-lítio empregam o lítio na forma iônica, que está presente no eletrólito pela dissolução de sais de lítio em solventes não aquosos. Durante o processo de descarga da bateria, os íons lítio deslocam-se do interior da estrutura que compõe o ânodo (grafite) até a estrutura que compõe o cátodo 2 (CoO2), enquanto os elétrons se movem através do circuito externo:
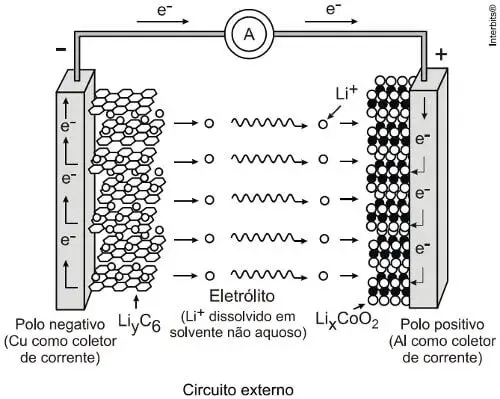
Nesse processo, o cobalto sofre uma alteração representada pela equação a seguir.
- Durante a descarga, o número de oxidação do cobalto aumenta.
- O cobalto recebe elétrons para haver a recarga da bateria.
- No cátodo, o cobalto é reduzido durante a descarga.
- O íon de lítio se desloca para o cátodo, durante a descarga, devido à atração magnética.
- O solvente utilizado entre os polos deve ser um líquido orgânico apolar.
09. (CESMAC)Atualmente, as baterias de íon lítio são amplamente utilizadas em celulares e computadores. As reações redox referentes ao processo de funcionamento da bateria lítio/cobalto estão representadas abaixo.
Li+ + e–→ Li(s) E° = − 3,0 V
CoO2(s) + Li+ + e–→ LiCoO2(s) E° = + 1,1 V
Com base nas equações acima, qual é o potencial da célula galvânica lítio/cobalto?
- + 1,9 V
- + 4,1 V
- − 1,9 V
- − 4,1 V
- + 2,0 V
10. Leia o texto a seguir:
[...] Baby, bye bye
Abraços na mãe e no pai
Eu acho que vou desligar
As fichas já vão terminar [...]
MENESCAL R.; HOLANDA, F. B. Bye, Bye, Brasil, 1980. Disponível em <http: //letras.terra.com.br/chico-buarque/45118 />
No trecho da letra da música Bye, Bye, Brasil, percebe-se a utilização de telefone público e não de celular. Nessa época, as baterias celulares não eram alvo de ambientalistas, pois os primeiros celulares chegaram ao Brasil nos anos 1990. De lá para cá, várias baterias de celulares foram desenvolvidas, incluindo as de íon lítio, cuja vantagem é o baixo peso.
Dados: Li (Z = 3)
Com relação a este elemento químico, é correto afirmar:
- O metal lítio é encontrado na natureza na forma elementar.
- O metal lítio reage com a água formando íonsH+(aq).
- O metal lítio apresenta uma alta reatividade em água.
- O átomo de lítio apresenta um próton a mais que o íon lítio.
- O átomo de lítio apresenta um nível energético preenchido a menos que o íon lítio.
11. (UDESC) As baterias classificadas como células secundárias são aquelas em que a reação química é reversível, possibilitando a recarga da bateria. Até pouco tempo atrás, a célula secundária mais comum foi a bateria de chumbo/ácido, que ainda é empregada em carros e outros veículos. As semirreações padrões que ocorrem nesta bateria são descritas abaixo:

Considerando a reação de célula espontânea, assinale a alternativa que apresenta a direção da semirreação I e seu eletrodo; a direção da semirreação II e seu eletrodo; e o potencial-padrão da bateria, respectivamente.
- direção direta no ânodo; direção inversa no cátodo; +1,33 V
- direção inversa no ânodo; direção direta no cátodo; +2,05V
- direção inversa no cátodo; direção direta no ânodo; +2,05 V
- direção direta no ânodo; direção inversa no cátodo; +2,05 V
- direção inversa no ânodo; direção direta no cátodo; +1,33V
12. (UNICENTRO) As pilhas e as baterias estão incorporadas ao cotidiano, mas sem a preocupação com o seu descarte. Sabe-se que determinados tipos de bateria e pilhas, de acordo com os resíduos, podem ou não ser descartadas no lixo doméstico.
Com base nos conhecimentos sobre esse tema, considere as afirmativas a seguir.
I. Baterias recarregáveis de níquel ou cádmio podem ser descartadas no lixo doméstico.
II. Pilhas de zinco ou manganês podem ser descartadas no lixo doméstico.
III. O chumbo, utilizado em baterias, é nocivo à saúde, pois tem efeito acumulativo no organismo humano.
IV. As baterias são um conjunto de pilhas ligadas em série.
Assinale a alternativa correta
- Somente as afirmativas I e II são corretas.
- Somente as afirmativas I e IV são corretas.
- Somente as afirmativas III e IV são corretas.
- Somente as afirmativas I, II e III são corretas.
- Somente as afirmativas II, III e IV são corretas.
13. (UPF) O chumbo metálico e seus derivados foram importantes para a sociedade por milhares de anos. Sua produção e consumo aumentaram significativamente a partir da Revolução Industrial. Assim como os usos, os efeitos nocivos são vários e conhecidos desde a antiguidade. Contudo, em função do conjunto de características físico-químicas que apresentam, sua utilização ainda se faz presente em baterias que são utilizadas em automóveis, por exemplo. A ilustração a seguir apresenta uma bateria ácido-chumbo.

Considere as seguintes afirmativas:
I. A bateria de ácido-chumbo é um dispositivo que, a partir de uma reação química, durante a descarga da bateria, produz energia elétrica, gerando uma quantidade de corrente elétrica por um curto período de tempo.
II. Na representação da equação global da bateria: Pb(s) + PbO2 (s) + 2 HSO4– (aq) + 2 H3O+ (aq) → 2 PbSO4(s) + 4 H2O(l), o metal chumbo é reduzido pelo agente redutor ácido sulfúrico, formando o sulfato de chumbo II.
III. O metal chumbo em um ambiente ácido e em presença de oxigênio se oxida facilmente ao cátion chumbo II, de acordo com a equação global representada: Pb(s) + O2(g) + 4 H3O+ (aq) → Pb2+ (aq) + 6 H2O(l)
Está correto o que se afirma em:
- I e III apenas.
- II e III apenas.
- II apenas.
- apenas.
- I e II apenas
14. (UFMG) Uma bateria de automóvel é constituída de uma sequência de células em que ocorre a reação (Dado: E0 = 2 V):

Numa bateria nova, a solução de H2SO4 tem densidade de 1,3 g/mL. Com relação a esse sistema, estão certas as afirmações a seguir, exceto:
- A fase líquida da bateria é corrosiva.
- Durante a carga, o PbSO4 é, simultaneamente, agente oxidante e redutor.
- Durante a descarga, a densidade do eletrólito diminui.
- Durante a descarga, o ânodo de uma célula é constituído de PbO2.
- Durante a descarga, a voltagem da bateria diminui.
15. (UNEB)
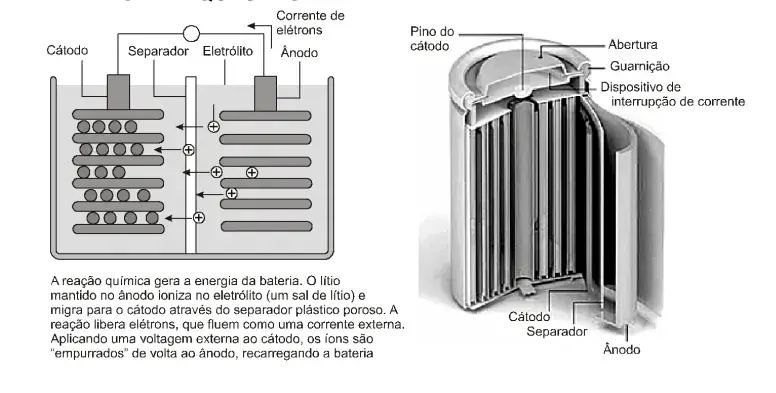
Grandes recalls de fabricantes de baterias de íons de lítio para notebooks suscitaram questões sobre como essas fontes de energia podem aquecer a ponto de pegar fogo. Igualmente válida é a dúvida sobre por que os acidentes não são mais frequentes: são poucos proporcionalmente às centenas de milhões de baterias vendidas anualmente. As células eletroquímicas de íons de lítio empregam vários materiais, mas quase todas são recarregáveis, como as usadas em câmeras fotográficas e telefones celulares, que utilizam óxido de lítio-cobalto no cátodo e grafite no ânodo. Embora essa formulação seja “de certo modo inerentemente insegura”, a fabricação cuidadosa e os dispositivos de segurança embutidos limitaram os acidentes a poucas ocorrências. Mesmo assim, os fabricantes de baterias têm aumentado a capacidade de carga em determinada célula devido à demanda dos fabricantes de eletrônicos por maior durabilidade. Portanto, agora a margem de erros é ainda menor. Aumentando o número de íons na célula, os fabricantes quadruplicaram a capacidade energética desde seu lançamento comercial em 1991. (FISCHETTI. 2013. p. 10-11).
O cátodo da célula eletroquímica é formado por óxido de lítio e de cobalto, LiCoO2(s), e o ânodo, por grafite, quando a bateria está descarregada. Durante a recarga, a corrente elétrica é invertida, e os íons de lítio são reduzidos no eletrodo do grafite. Na descarga, os íons de lítio, Li+, deixam o grafite, após reação e voltam a formar óxido de lítio e de cobalto. Com base nas informações do texto, das figuras e considerando-se o funcionamento de célula eletroquímica e a força eletromotriz de célula igual a 3,7V, é correto afirmar:
- O eletrólito é uma solução aquosa de sal de lítio.
- O óxido de LiCoO2 é oxidado a CoO2, na recarga da pilha.
- A oxidação e a redução ocorrem, respectivamente, no cátodo e no ânodo, durante a descarga da pilha.
- A voltagem de bateria, formada a partir da ligação em paralelo de quatro células eletroquímicas de óxido de lítio-cobalto, é, aproximadamente, 15V.
- A ligação entre o cátodo e o ânodo através do separador, por meio de partículas metálicas, desvia o fluxo de corrente elétrica e causa resfriamento da célula eletroquímica.
16. (UFG) Baterias de níquel-hidreto metálico, MH, são empregadas em aparelhos eletrônicos como telefones, máquinas fotográficas etc. Considere que a reação global desse tipo de bateria seja
MH + NiO(OH) → M + Ni(OH)2
com uma diferença de potencial de saída de 1,35 V. Teoricamente, a tensão mínima, em volts, que se deve aplicar para recarregar essa bateria é de:
- -0,5
- -1,0
- +0,5
- +1,0
- +1,5