Química Geral I
Lista de 15 exercícios de Química com gabarito sobre o tema Química Geral I com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Geral I.
01. (EAM) Em relação aos átomos dos elementos químicos 11X, 17Y e 18Z no estado fundamental, analise as afirmações abaixo
I - Pertencem aa mesmo período da tabela periódica.
II - Pertencem ao mesmo grupo da tabela periódica.
III - X e Y são metais e Z é um ametal.
IV - X, Y e Z são elementos representativos.
V - X é um metal alcalino, Y é halogênio e Z é um gás nobre.
São verdadeiras apenas as afirmativas
- I, III e V
- I, II e IV
- I, IV e V
- II, III e IV
- III, IV e V
02. (EsPCEx) O critério utilizado pelos químicos para classificar as substâncias é baseado no tipo de átomo que as constitui. Assim, uma substância formada por um único tipo de átomo é dita simples e a formada por mais de um tipo de átomo é dita composta.
Baseado neste critério, a alternativa que contém apenas representações de substâncias simples é:
- HCl, CaO e MgS.
- Cl2, CO2 e O3.
- O2, H2 e I2.
- CH4, C6H6 e H2O.
- NH3, NaCl e P4.
03. (EAM) Observe a sequência de quadrinhos abaixo.
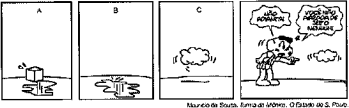
De acordo com os quadrinhos acima, é correto afirmar que as mudanças de estados físicos apresentados na sequência A --> B e B --> C são, respectivamente
- fusão e condensação.
- sublimação e liquefação.
- liquefação e vaporização .
- solidificação e condensação.
- fusão e vaporização.
04. (EsPCEx) Em uma aula prática de química, o professor forneceu a um grupo de alunos 100 mL de uma solução aquosa de hidróxido de sódio de concentração 1,25 mol·L-1. Em seguida solicitou que os alunos realizassem um procedimento de diluição e transformassem essa solução inicial em uma solução final de concentração 0,05 mol·L-1. Para obtenção da concentração final nessa diluição, o volume de água destilada que deve ser adicionado é de
- 2400 mL.
- 2000 mL.
- 1200 mL.
- 700 mL.
- 200 mL.
05. (EAM) Assinale a opção que apresenta, na sequência, os termos corretos que preenchem as lacunas da seguinte afirmativa.
“Uma substância______ é formada por______ , contendo apenas______ de um mesmo______.
- simples / átomos / elementos / íon.
- simples / moléculas / átomos / elemento.
- composta / moléculas / átomos / elemento.
- composta / átomos / elementos / ion.
- composta / elementos / moléculas / átomo.
06. (EsPCEx) Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração eletrostática.
(Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes afirmativas:
I – apresentam brilho metálico.
II – apresentam elevadas temperaturas de fusão e ebulição.
III – apresentam boa condutibilidade elétrica quando em solução aquosa.
IV – são sólidos nas condições ambiente (25 °C e 1atm).
V – são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
- II, IV e V.
- II, III e IV.
- I, III e V.
- I, IV e V.
- I, II e III.
07. (CN) De modo geral, as variedade alotrópicas de uma determinada substâncias são caracterizadas por:
- serem substâncias simples e possuírem um mesmo elemento químico formador
- apresentar sempre a mesma atomicidade e idêntica estrutura cristalina.
- possuírem propriedades físico-químicos iguais.
- terem sempre a mesma configuração eletrônica no estado fundamental.
- aparecem sempre na forma de átomos isolados e possuírem baixa reativadade.
08. (EsPCEx) O carvão e os derivados do petróleo são utilizados como combustíveis para gerar energia para maquinários industriais. A queima destes combustíveis libera grande quantidade de gás carbônico como produto. Em relação ao gás carbônico, são feitas as seguintes afirmativas:
I - é um composto covalente de geometria molecular linear.
II - apresenta geometria molecular angular e ligações triplas, por possuir um átomo de oxigênio ligado a um carbono.
III - é um composto apolar.
Das afirmativas apresentadas está(ão) correta(as)
- apenas II.
- apenas I e II.
- apenas I e III.
- apenas II e III.
- todas.
09. (CN) Os elementos xA, x+1B e x+2C pertencem a um mesmo período da tabela periódica.
Sendo assim, se B é um halogênio, é correto afirmar que A:
- tem 5 elétrons no último nível e C tem 7 elétrons no último nível.
- tem 6 elétrons no último nível e C tem 2 elétrons no último nível.
- é um metal e C é um não metal.
- é um metal alcalino e C é um gás nobre.
- é um calcogênio e C é um gás nobre.
10. (EsPCEx) Um átomo neutro do elemento químico genérico A, ao perder 2 elétrons forma um cátion bivalente, contendo 36 elétrons. O número atômico deste átomo A é
- 36
- 42
- 34
- 40
- 38
11. (EEAR) Um balão de borracha preto foi preenchido com ar e exposto ao sol. Após certo tempo tende a se mover para cima se não estiver preso a algo. Uma possível explicação física para tal acontecimento seria:
- O aquecimento do ar dentro do balão causa uma propulsão em seu interior devido à convecção do ar;
- O aumento da temperatura dentro do balão diminui a densidade do ar, fazendo com que o empuxo tenda a ficar maior do que o peso;
- A borracha do balão tem a sua composição alterada, tornando-o mais leve;
- O aquecimento do ar diminui a massa do mesmo dentro do balão, tornando-o mais leve.
12. (EsPCEx) O sódio metálico reage com água, produzindo gás hidrogênio e hidróxido de sódio, conforme a equação não balanceada:Na(s) + H2O(l) → NaOH(aq) + H2 (g)
Baseado nessa reação, são feitas as seguintes afirmativas:
I – O sódio atua nessa reação como agente redutor.
II – A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III – Os dois produtos podem ser classificados como substâncias simples.
IV – Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
- Todas.
- apenas I, II e III.
- apenas I, II e IV.
- apenas I, III e IV.
- apenas II, III e IV.
13. (CN) O elemento químico Al (alumínio), largamente utilizado em utensílios domésticos, tem número atômico 13, número de massa 27 e seu íon Al3+ é muito utilizado no solo.
Assinale a opção que apresenta, respectivamente, o número de prótons, elétrons e nêutrons presentes no fon Al3+.
- 13, 10, 14
- 10, 10, 14.
- 13, 13, 27.
- 10, 10, 27.
- 13, 16, 14.
14. (EsPCEx) Considere as seguintes afirmações, referentes à evolução dos modelos atômicos:
I - No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II - No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como planetas em torno do Sol.
III - O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s)
- apenas III.
- apenas I e II.
- apenas II e III.
- apenas II.
- todas.
15. (CN) Qual é a massa (expressa em gramas) de uma amostra com volume de 3 mL de álcool etílico, e cujo valor de sua densidade, nas condições de temperatura e pressão em que se encontra, é de 0,79 g/mL?
- 0,26
- 2,37
- 2,73
- 3,79
- 8,78