Ligações Químicas (EsPCEx)
Lista de 09 exercícios de Química com gabarito sobre o tema Ligações Químicas (EsPCEx) com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Ligações Químicas (EsPCEx).
01. (EsPCEx 2017) Conversores catalíticos de automóveis são utilizados para reduzir a emissão de poluentes. Os gases resultantes da combustão do motor e o ar passam por substâncias catalisadoras que aceleram a transformação de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio (genericamente (NxOy) em gás nitrogênio (N2) e gás oxigênio (O2). Em relação ao uso de catalisadores e as substâncias citadas no texto, são feitas as seguintes afirmações:
I – As reações de decomposição dos óxidos de nitrogênio a gás oxigênio e a gás nitrogênio ocorrem com variação no número de oxidação das espécies.
II – O CO2 é um óxido ácido que quando reage com a água forma o ácido carbônico.
III – Catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação.
IV – O monóxido de carbono é um óxido básico que ao reagir com a água forma uma base.
V – A molécula do gás carbônico apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas:
- I e II
- II e V
- III e IV
- I, III e V
- II, IV e V
02. (EsPCEx 2008) Os tipos de ligações químicas existentes nas substâncias cloreto de sódio (NaCl), gás cloro (Cl2) e água (H2O) são, respectivamente:
- iônica, covalente apolar e covalente polar
- iônica, covalente polar e covalente apolar
- iônica, covalente apolar e covalente apolar
- covalente apolar, iônica e covalente polar
- covalente polar, iônica e covalente apolar
03. (EsPCEx 2014) As substâncias ozônio (O3); dióxido de carbono (CO2); dióxido de enxiofre (SO2); água (H2) e cianeto de hidrogênio (HCN) são exemplos que representam moléculas triatômicas. Dentre elas, as que apresentam geometria molecular linear são apenas:
Dados: 1H1;
6C12;
8O16;
16S32;
7N14.
- Cianeto de hidrogênio e dióxido de carbono
- Água e cianeto de hidrogênio
- Ozônio e água
- Dióxido de enxofre e dióxido de carbono
- Ozônio e dióxido de enxofre
04. (ESPCEX) Assinale a alternativa correta: Dados
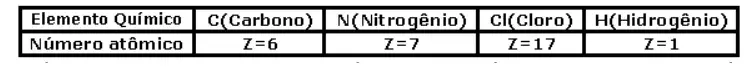
- A fórmula estrutural N N indica que os átomos de nitrogênio estão compartilhando três pares de prótons.
- A espécie química NH4+ (amônio) possui duas ligações covalentes (normais) e duas ligações covalentes dativas (coordenadas).
- O raio de um cátion é maior que o raio do átomo que lhe deu origem.
- Na molécula de CCl4, a ligação entre o átomo de carbono e os átomos de cloro é do tipo iônica.
- Se em uma substância existir pelo menos uma ligação iônica, essa substância será classificada como um composto iônico.
05. (ESPCEX – 2016) Compostos iônicos são aqueles que apresentam ligação iônica.
A ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração eletrostática.
(Texto adaptado de: Usberco, João e Savador, Edgard, Química: Química Geral, vol 1, pág 225, Saraiva, 2009). Sobre as propriedades e características de compostos iônicos são feitas as seguintes afirmativas:
I. Apresentam brilho metálico
II. Apresentam elevadas temperaturas de fusão e ebulição
III. Apresentam boa condutibilidade elétrica quando em solução aquosa
IV. São sólidos nas condições ambientes (25◦C e 1 atm)
V. São pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas:
- II, IV e V
- II, III e IV
- I, III e V
- I, IV e V
- I, II e III
06. (EsPCEx 2018) Quando ocorre a combustão completa de quaisquer hidrocarbonetos, há a produção dos compostos gás carbônico (CO2) e água (H2O). Acerca dessas substâncias afirma-se que:
I – as moléculas CO2 e H2O apresentam a mesma geometria molecular.
II – a temperatura de ebulição da água é maior que a do CO2, pois as moléculas de água na fase líquida se unem por ligação de hidrogênio, interação intermolecular extremamente intensa.
III – a molécula de CO2 é polar e a de água é apolar.
IV – a temperatura de fusão do CO2 é maior que a da água, pois, diferentemente da água, a molécula de CO2 apresenta fortes interações intermoleculares por apresentar geometria angular.
V – o número de oxidação (Nox) do carbono na molécula de CO2 é +4.
Estão corretas apenas as afirmativas
- I, II e IV.
- II, III e IV.
- I, III e V.
- III e IV.
- II e V.
07. (ESPCEX – 2016) Compostos contendo enxofre estão presentes, em certo grau, em atmosferas naturais não poluídas, cuja origem pode ser: decomposição de matéria orgânica por bactérias, incêndio de florestas, gases vulcânicos etc. No entanto, em ambientes urbanos e industriais, como resultado da atividade humana, as concentrações desses compostos é alta. Dentre os compostos de enxofre, o dióxido de enxofre (SO2) é considerado o mais prejudicial à saúde, especialmente para pessoas com dificuldade respiratória.
(Adaptado de BROWN, T.L. et al, Química a Ciência Central. 9ª edição, Ed. Pearson, São Paulo, 2007).
Em relação ao composto SO2 e sua estrutura molecular, pode-se afirmar que se trata de um composto que apresenta:
- ligações covalentes polares e estrutura com geometria espacial angular.
- ligações covalentes apolares e estrutura com geometria espacial linear.
- ligações iônicas polares e estrutura com geometria espacial trigonal plana.
- ligações covalentes apolares e estrutura com geometria espacial piramidal.
- ligações iônicas polares e estrutura com geometria espacial linear
08. (EsPCEx 2009) Assinale a alternativa correta:
- A condutividade elétrica dos metais é explicada admitindo-se a existência de nêutrons livres.
- O nitrato de sódio é um composto iônico, mas que apresenta ligações covalentes entre o átomo de nitrogênio e os átomos de oxigênio.
- Uma molécula com ligações polares pode somente ser classificada, quanto à sua polaridade, como uma molécula polar.
- Não existe força de atração entre moléculas apolares.
- As forças de atração entre as moléculas do ácido bromídrico são denominadas ligações de hidrogênio.
09. (EsPCEx 2002) Um átomo que possui em sua camada de valência 6 elétrons faz uma ligação com um elemento químico da família dos alcalino-terrosos. O resultado dessa ligação fornece um composto químico que, ao ser adicionado à água, forma uma base cujo coeficiente de solubilidade é de 42 g/100 mL de água a 25°C.
Com base no texto, são feitas as seguintes afirmações:
I. A ligação formada é covalente.
II. O composto químico pode ser o Na2O.
III. A base formada pode ser o Ca(OH)2.
IV. Pode-se dizer que a base formada é mais solúvel que o NaCl, cuja solubilidade é de
40 g/100 mL de água a 25°C.
Estão corretas apenas as afirmativas
- I e II
- I e IV
- II e III
- II e IV
- III e IV